<図1>低分子二重特異性抗体Ex3の模式図とドメインの配向性の改変による高機能化
ヒト上皮増殖因子受容体(EGFR)とTリンパ球表面抗原CD3を標的とした低分子二重特異性抗体に顕著ながん細胞の傷害活性がみられた。またドメインの配向性を改変することで機能と発現量の増減がみられた。
ホーム > 平成27年度採択課題 > 次世代バイオ医薬品を目指した低分子二重特異性抗体の基盤技術開発
研究開発代表者:浅野 竜太郎
東京農工大学 大学院工学研究院 准教授

これまでに研究代表者らが開発してきた低分子二重特異性抗体医薬シーズであるEx3(図1)は、担がんマウスモデルに於ける薬効、および製剤化に十分な安定性を有していることを確認してきましたが、既存の調製技術では、実製造プロセスを見据えることはできませんでした。 即ち、言い換えれば新たに調製に係る革新的な基盤技術を確立することができれば、このEx3のみならず同様の低分子抗体医薬の実用化を加速させることが期待できます。 本プロジェクトでは、より実用化に適した分子設計、遺伝子配列の改変を応用した微生物発現の最適化、プロテインLを利用した高効率精製の観点から低分子二重特異性抗体の調製に係る基盤技術開発を進めます。 宿主微生物としては、汎用的に用いられている大腸菌と酵母に加え、組換えタンパク質の分泌生産に優れ、エンドトキシンを持たないことから、低コストでの製造プロセス構築が期待できるブレビバチルス菌を用いた検討を行います(図2)。
我々は近年、低分子二重特異性抗体の構成するドメインの連結順を入れ換えた配向性改変体を作製することで、発現量やがん細胞傷害活性が増減することを見出しました。 一方で、Ex3は非共有性の相互作用により会合した二量体タンパク質であるため、製造プロセス過程や保存中に、分子が解離してしまう恐れがあります。 すべての構成するドメインを連結させた構造であるsingle-chain diabody (scDb)型やtandem scFv (taFv)型は、この解離の懸念はありませんが、それぞれ8通りの配向性が考えられ、これらの配向性の違いが及ぼす発現量や機能への影響を検証した例はありません。 そこで、本プロジェクトでは、まず配向性が異なる低分子二重特異性抗体の発現ベクターを網羅的に作製し、大腸菌、酵母、ブレビバチルス菌をそれぞれ発現宿主として用いて調製し、機能と生産量の比較を行います。 機能の保持と生産量の観点から至適な宿主と配向性の選抜を行い、さらなる生産量の向上を配列の最適化により、また精製の効率化をプロテインLの機能向上の観点から進めます。 分担機関である株式会社プロテイン・エクスプレスは、ブレビバチルス菌発現系と低分子抗体の精製に効果的な高機能化プロテインL変異体に関する独自の技術を有しています。 研究代表者らが開発したEx3をモデル医薬シーズとして用い、それぞれの技術を統合、有機的な連携を図ることで一連の技術をパッケージングさせ、低分子二重特異性抗体の実用化を加速させるための基盤技術として関連企業への導出を目指します。

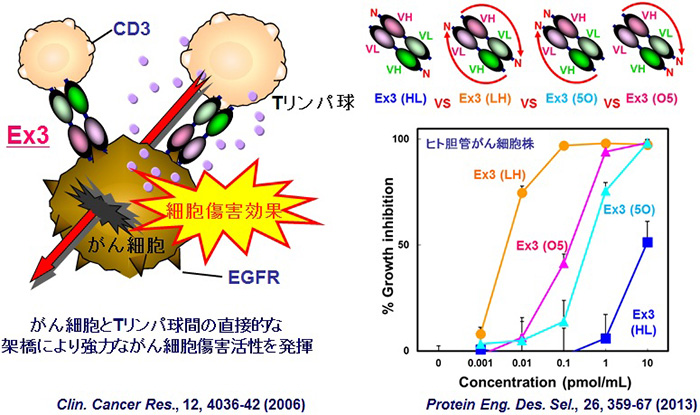
ヒト上皮増殖因子受容体(EGFR)とTリンパ球表面抗原CD3を標的とした低分子二重特異性抗体に顕著ながん細胞の傷害活性がみられた。またドメインの配向性を改変することで機能と発現量の増減がみられた。
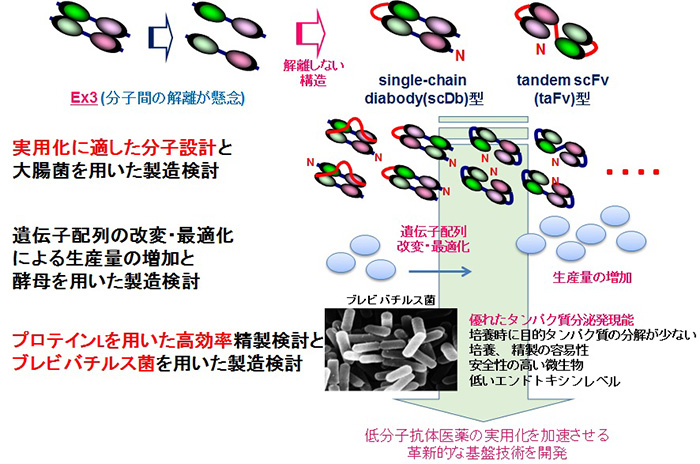
Ex3を分子間が解離しない構造であるscDb型とtaFv型に改変後、配向性が異なる分子を、大腸菌、酵母、ブレビバチルス菌をそれぞれ発現宿主として用いて網羅的に調製し、機能と生産量の観点から至適な宿主と配向性の選抜を進めます。続いて、さらなる生産量の向上を遺伝子配列の最適化、精製の効率化をプロテインLの機能の向上により達成し、低分子抗体の基盤技術を完成させます。