革新的なバイオ医薬品の創出に向けて
医薬品の開発は、我が国が目指している知識集約型産業の良い例であり、高齢化により増加する市場を背景に、日本再興戦略でも次世代の成長産業として位置づけられています。 現在の新薬は、従来の化学合成に基づく「低分子医薬品」だけに頼ることは難しくなり、バイオテクノロジーに基づく「バイオ医薬品」の創出が期待されていますが、我が国ではバイオ医薬品開発で欧米に出遅れたと言われています。 そこで、文部科学省「革新的バイオ医薬品創出基盤技術開発事業」が、平成26年度から5年度の事業計画でスタートしました。 我が国の国際競争力を強化するため、当該分野が抱える技術的課題を解決し、知財やノウハウを企業に繋ぎ(導出)、日本発の革新的な次世代バイオ医薬品を創出しなければいけないからです。
日本の基礎研究レベルは高く、医薬品開発においても、多くの基礎研究成果が蓄積され、創薬標的に対する情報も充溢しています。 近年の実用化研究を加速する様々な政策の下、アカデミアからの医薬品開発は、低分子医薬品を中心に、基礎研究からヒトでの有効性を確認する医師主導治験(POCの取得)までを繋げる環境が整備されてきました。 現在では、医薬品開発業務受託機関(CRO/CMO)などとうまく協業すれば、アカデミアからでもヒット化合物探索から始まって構造最適化、GMP合成/製剤、非臨床GLP試験を経て、医師主導治験まで実施することが可能になりました。 低分子医薬品は、化学合成により構造や品質が均一な製品を製造できますし、現在の分析技術で簡単に構造・品質解析が可能ですから、アカデミアからでも比較的簡単に開発実績やノウハウを蓄積できつつ有ります。
これに対し、バイオ医薬品は分子量が大きく、構造も遥かに複雑です。 ある一定の品質を確保するためには、培養条件、精製や濃縮など厳密な管理が必要で、大量の製品の同等性を確保することが難しい分野です(低分子医薬品の後続品であるジェネリック開発とバイオ医薬品の後続品であるバイオシミラー開発のハードルの高さの違いを見ても明らか)。 アカデミアとバイオ医薬品専門のCRO/CMO(バイオCRO)との連携も極めて乏しいために、たとえアカデミアが革新的なシーズの開発に理論的に成功したとしても、実用化までのハードルはまだまだ高い状況にあると言えます。 低分子医薬品と異なり、多くの製薬企業にも十分な経験・ノウハウが蓄積できていません。 現在、世界の医薬品市場の主要品目では、抗体医薬を中心とするバイオ医薬品が1/3以上を占めるに至っていますが、このうち日本発のシーズを上市している製薬企業は数社だけです。 このように、アカデミア、バイオCRO、製薬企業(バイオベンチャー)すべてが当該分野で独立して経験を積んでいる段階で、それら連携や協業はこれからの課題になっています。
日本発の革新的な次世代バイオ医薬品を創出するためには、単に要素技術やシーズ(コンセプト)を発見するだけではなく、複数の革新的な要素技術の組み合わせで付加価値や実用化可能性を高めたり、アカデミア、バイオCRO、製薬企業(バイオベンチャー)間でのオープンイノベーションの「場」を提供して経験やノウハウを繋いだりするなど、多くの課題を抽出して解決しなければいけません。 そうでなければ、学術的に画期的な成果を出したとしても(日本からは達成できると思います)、生産技術上の課題、知的財産上の課題、薬事法上の課題、コミュニケーション・ネッワーク上の課題がネックとなり、革新的な次世代バイオ医薬品は生まれません。
多くのアカデミアシーズは開発の初期段階であり(育成フェーズ)、この初期段階でしっかりとした動機づけあるいは出口(導出や実用化)を見据えた支援をする必要があります。 また、製薬企業は、アカデミア発の全てのシーズを導入してくれるわけではありませんから、ただちに導出できないシーズは、アカデミア側で、適宜バイオCROなどを活用した上で、マテリアルの最適化、品質保証、薬事法に則ったGLP試験というステップを踏んで育成していかねばなりません。 低分子医薬品の開発とは異なった経験やノウハウをこれから蓄積していかねばならないわけです。 本事業の趣旨とは若干違いますが、各研究開発課題の推進と並行して、このような問題解決に向けた議論や対応も重要であると認識しております。
バイオ医薬品は、低分子医薬品に比べ、その歴史も浅く、開発上の様々な課題がありますが、一方では革新的な医薬品が生み出されるポテンシャルも秘めています。 平成26、27年度で26件の多様な研究開発課題を採択しました。 これらは、いずれも革新的バイオ医薬品につながるポテンシャルを秘めたシーズや技術基盤であり、これら研究の進展を楽しみにしています。 幸い、バイオ医薬品開発に精通した専門家の方々に本事業を管理推進する推進委員にご就任いただいていますので、皆で協力して柔軟な事業運営を行い、当事業を有意義なものとしたいと思います。
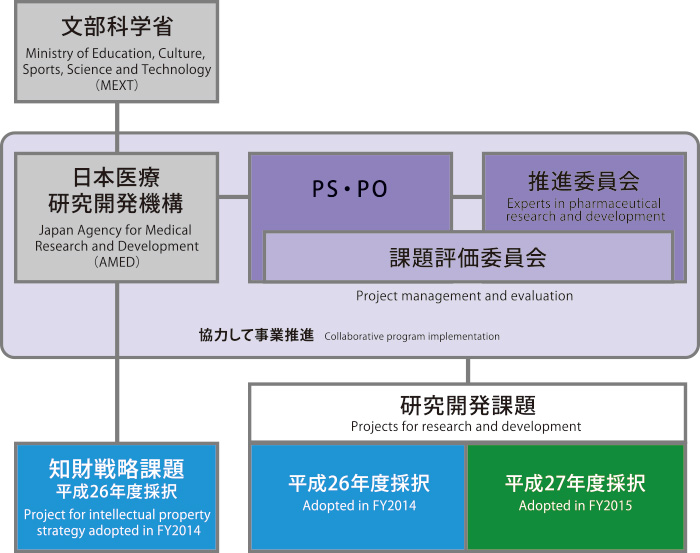
平成27年4月からは、本事業は日本医療研究開発機構(AMED)に移管され、「オールジャパンでの医薬品創出」の一つの柱となりました。 日本医療研究開発機構で予定される他の事業とも連携を図るとともに、規制当局、さらには民間企業(バイオベンチャー、バイオCRO、製薬企業)とも対話を交えながら、活動して参りたいと思います。 皆様方のご支援を切にお願いする次第です。