平成26年度採択研究開発課題
特殊環状ペプチドを中核とした革新的次世代バイオ医薬品開発の加速
研究開発代表者:菅 裕明
東京大学 大学院理学系研究科 教授
近年の生命科学研究の急速な発展は、人類の健康維持・管理に関する革新的な技術を生み出し、病気の診断や治療を飛躍的に向上させてきました。
その中でも医薬品は、病人ばかりでなく健康人に至るまで、その健康を維持し、また疾患をコントロールし治療するには欠くことのできないものであります。
現在でも、医薬品開発の主流は、製造コストが低く、経口投与が可能であり、免疫毒性がない低分子(有機小分子)薬剤であります。
しかし、その一方で、低分子薬剤の疾患原因標的タンパク質に対する結合能は、主に疎水性相互作用に依存しており、標的としていないタンパク質へ非特異的に結合が起きてしまい、結果として副作用障害が起きるリスクがあります。
また、これまで低分子薬剤が得意とする疾患原因タンパク質への薬剤開発はやりつくされたとも言われており、近年その重要性が解明されてきたタンパク質・タンパク質相互作用(PPI)を阻害する薬剤の開発は低分子薬剤では難しいといった問題を抱えています。
このような問題を解決する手段として、近年、バイオベンチャー企業等を中心に、標的タンパク質へ高い特異性をもつ抗体やタンパク質そのものの製剤化を目指した研究開発が精力的に行われ、この10年あまりで様々なタンパク製剤が開発されてきました。
この副作用が少なく薬理効果の高いタンパク製剤は、低分子薬剤に代わる薬剤として非常に期待が高い反面、標的タンパク質が細胞表面分子や分泌分子に限られているため、応用範囲が限定される問題を抱えています。
さらに、免疫毒性や生産コストが高いことも、薬剤として汎用性を低減させる要因であるばかりから、結果的に患者への負担も大きいことが指摘されています。
そういった中、低分子薬剤やタンパク製剤に代わる次世代薬剤として、近年特殊ペプチドに期待が集まってきています。実は、特殊ペプチド自体決して新しい薬剤ではありません。
例えばサイクロスポリンA(免疫抑制剤)は、天然物として単離され、製剤化された特殊ペプチドとしてよく知られています。しかし、このような天然由来の特殊ペプチド医薬を人工的にライブラリー化することが極めて難しいため、様々な特殊ペプチド薬剤の発見や開発には至っていません。
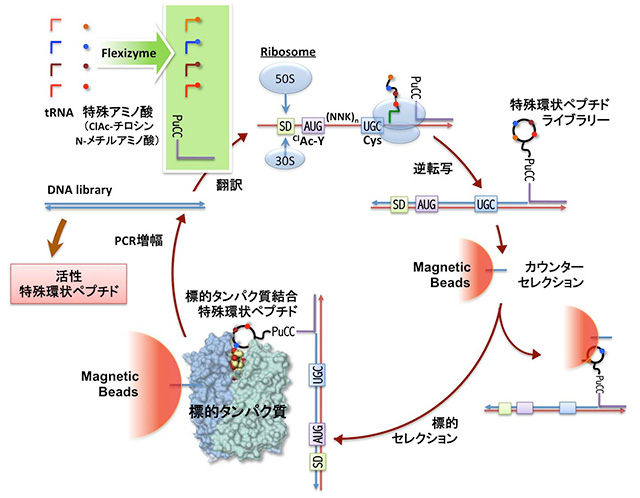
菅らは、この問題を一挙に解決できるブレークスルー技術RaPID(Random non-standard peptide integrated discovery)システムを開発しました(図1)。
RaPIDシステムは、菅らが独自に開発した人工RNA酵素「フレキシザイム」と大腸菌再構成無細胞翻訳系を組み合わせたFIT(Flexible In-vitro Translation)システムに、ディスプレイ技術を組み合わせて構築されました。
本システムは、mRNA(もしくはその鋳型となるDNA)を鋳型として、特殊アミノ酸を取り込んだ特殊ペプチドを自在かつ簡便に合成し、活性種を迅速且つ安価にスクリーニングする技術です。
このRaPIDシステムにおける「探索」とは、いわゆる古典的な化合物の大規模スクリーニングではなく、mRNAと特殊環状ペプチドを融合することで個々の特殊環状ペプチド配列が遺伝暗号にコードされた対応をもたせ、活性種を単離濃縮した後、その鋳型核酸配列を増幅することで実施します。
すなわち、探索→活性種の濃縮→増幅→再合成→探索の過程を無細胞条件下で繰り返すことができるセレクションシステムです。
この技術を駆使すれば、翻訳合成された1兆種類から成る特殊環状ペプチドライブラリーから、抗体並みの選択性と強さで任意の標的タンパク質を阻害する特殊環状ペプチドを数週間で同定することができます(図1)。
事実、菅らは既に30種類を超える疾患原因標的タンパク質について探索を行い、9割を超える成功確率で対応する特殊環状ペプチドの取得に成功しています。特殊ペプチドは、抗体よりも遙かに低分子量(2,000〜3,000 Da)であり、低分子のように細胞膜を透過できる可能性も秘めています。
任意の生理活性を示す新規特殊環状ペプチドを、ここまでの信頼性と迅速性で取得できる競合技術は存在せず、RaPIDシステムは日本発・世界初の創薬基盤技術と言えます。
本プロジェクトでは、このRaPIDシステムを基盤技術として活用することで、そこから生み出される特殊環状ペプチドを日本発の次世代バイオ医薬品として確固たる地位を確立させ、医薬品開発のパラダイムシフトを起こすことを達成目標としています。
具体的には下記の中核技術目標と要素技術目標を設定しています。
- 中核技術目標(1):疾患細胞特異的な薬剤デリバリービークルとしての技術革新
- 疾患細胞を特異的に認識する特殊環状ペプチドに薬剤を共役したcPDC(cyclic Peptide-Drug Conjugate)技術を確立し、「薬剤デリバリビークル」開発の技術革新を進めます。
- 中核技術目標(2):中分子医薬品としての技術革新
- 細胞膜を透過し、細胞内のタンパク質間相互作用(Protein-Protein Interaction, PPI)を効率的に阻害する特殊環状ペプチドの探索法を確立し、「中分子医薬品」開発の技術革新を進めます。
- 要素技術目標(3):医療応用としての技術革新
- 上記の中核技術から生まれる特殊環状ペプチドの生体内薬効評価と医療応用への突破口を開き、次世代バイオ医薬品としての実績を積みます。
<図1>RaPIDシステム
特殊環状ペプチドライブラリーの翻訳合成とmRNAディスプレイを組み合わせることで、標的蛋白質に結合する活性種を濃縮、さらにその活性種をコードしているcDNAを回収してPCRにより増幅をすることで再びmRNAを転写、この過程を繰り返すことで高い親和性と特異性をもつ特殊環状ペプチドを同定する手法(菅オリジナルの技術)。N-chloroacetyl-Tyrosine(ClAc-Y)は、翻訳したペプチドのN末端とランダム配列下流に導入したシスティン残基側鎖(C-SH)と自発反応させ大環状化(Macrocyclization)させることで、還元的に安定なチオエーテル結合を形成させる為に遺伝暗号リプログラミング法により導入。SDはリボソーム結合配列、(NNK)nのnは通常は8〜15の混合物、NはUAGCの混合物(DNAの場合はU = T)、KはUかGの混合物(すなわち翻訳後は8〜15merの長さのランダムペプチド鎖)、(GGC AGC)3は翻訳されると(GS)3のペプチドリンカーになる。