<図1>
食道がんと精巣腫瘍に対する免疫組織染色において、CasMab(左上図、左下図)とnon-CasMab(右上図、右下図)は、共に、がん細胞に対して反応性を示す(赤矢印)。一方、CasMabは正常組織には反応しないのに対し、non-CasMabは正常組織にも反応性を示す(青丸の中)。このように、同じ配列のタンパク質ががん細胞と正常細胞の両方に発現している場合は、CasMabはがん細胞のみを攻撃できる。
ホーム > 平成26年度採択課題 > 革新的次世代型がん特異的抗体の開発とその臨床応用
研究開発代表者:加藤 幸成
東北大学 大学院医学系研究科 教授

我々は近年、がん細胞に特異的反応性を示すモノクローナル抗体(CasMab;キャスマブ)を作製する技術を開発しました。CasMab法は、がん細胞のみを攻撃する抗体を高い効率で作製する戦略的プラットフォームです。 新規の標的に対する抗体医薬の開発だけでなく、既存の抗体医薬品を副作用のほとんどない抗体医薬品に置き換えることが可能となりました。 がん細胞に高発現しているが正常細胞にも発現していることで、抗体医薬の開発が断念されていたような標的に対しても、再び抗体医薬の開発に挑戦することができます。 また、悪性脳腫瘍や悪性中皮腫のような、全く治療法の開発されていない難治性のがんに対する抗体医薬の開発にも取り組んでいます。
従来の抗体医薬開発では、その標的の絞り方や開発方法には複数の問題点があります。例えば、DNAマイクロアレイなどの遺伝子発現解析により、がん細胞/正常細胞比が高い抗原が標的となっていました。 そのため、がん細胞に高発現していても正常組織にも発現していると、最初から候補分子から外れるというのが一般的でした。 また、がん細胞と正常細胞に共通に発現している膜タンパク質の糖鎖構造の差を質量分析計などによって検出しようとしても、膜タンパク質への糖鎖付加には不均一性があるため、がん細胞特異的糖鎖構造の検出には限界があります。 さらに、がん特異的糖鎖構造が発見されたとしても、特にO型糖鎖を人工的に大量合成することは非常に困難です。従って、がん特異的糖鎖構造を付加した膜タンパク質を、免疫原やスクリーニングに使用する段階には至っていません。 これらの問題点をすべて解決する方法を検討した結果、CasMab法の開発に至りました。
がん細胞と正常細胞に同一のアミノ酸配列の膜タンパク質が発現している場合、糖鎖などの翻訳後修飾の違いを利用し、がん細胞のみに反応する抗体を樹立するのがCasMab法ですが、これには複数の独自技術が必要となります。 すなわち、①糖鎖を中心としたがん特異的抗原を発現した特殊ながん細胞株を樹立すること、②特殊ながん細胞株に目的遺伝子を導入し免疫原を作製すること、③膜タンパク質精製のための新規タギンング技術を開発すること、④独自の抗体工学や細胞工学を用いた抗体改変技術を開発すること、などです。 すでに我々は、ポドプラニンという転移促進因子に対するCasMabの開発に成功しています。ポドプラニンは、リンパ管や肺胞上皮細胞のような正常細胞にも高発現しており、抗体医薬の標的にはならないとされていました。 しかし、ポドプラニンに対するCasMabを作製することにより、ポドプラニンが高発現する脳腫瘍・肺がん・食道がん・悪性中皮腫などを抗体医薬で治療することが現実的となってきました。また、PAタグという独自タグを開発することで、精製が困難とされる膜タンパク質の精製にも成功しています。 本プロジェクトでは、さらに各要素技術を磨き上げ、複数の標的に対してCasMabを開発していきます。




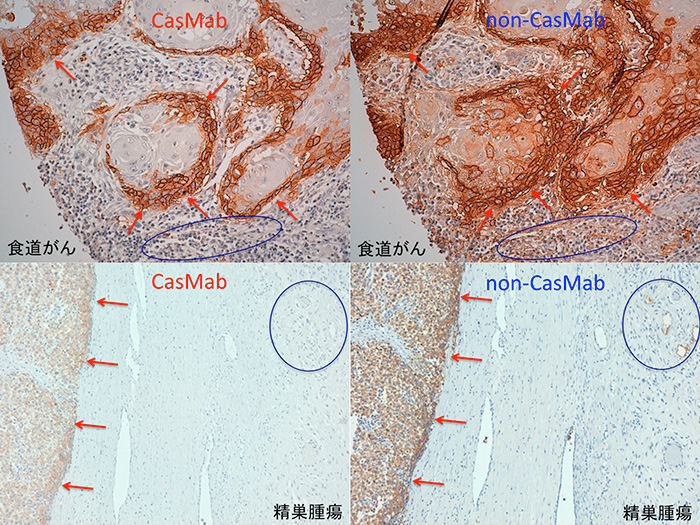
食道がんと精巣腫瘍に対する免疫組織染色において、CasMab(左上図、左下図)とnon-CasMab(右上図、右下図)は、共に、がん細胞に対して反応性を示す(赤矢印)。一方、CasMabは正常組織には反応しないのに対し、non-CasMabは正常組織にも反応性を示す(青丸の中)。このように、同じ配列のタンパク質ががん細胞と正常細胞の両方に発現している場合は、CasMabはがん細胞のみを攻撃できる。