平成26年度採択研究開発課題
アンメット疾患領域を開拓するスマートなケモバイオ抗体
研究開発代表者:梅津 光央
東北大学 大学院工学研究科 教授
私どもの研究は、医学・薬学・工学を専門とする研究者が連携し、低分子医薬のように豊富な標的分子を対象として多様な作用機序の機能を持ち、かつ、抗体のような標的特異性と良好な薬物動態を併せ持つケモバイオ抗体を創り出し、腎臓病のようなアンメットな疾患の標的分子をターゲットにできる医薬品フォーマットを提案することを目的としています。
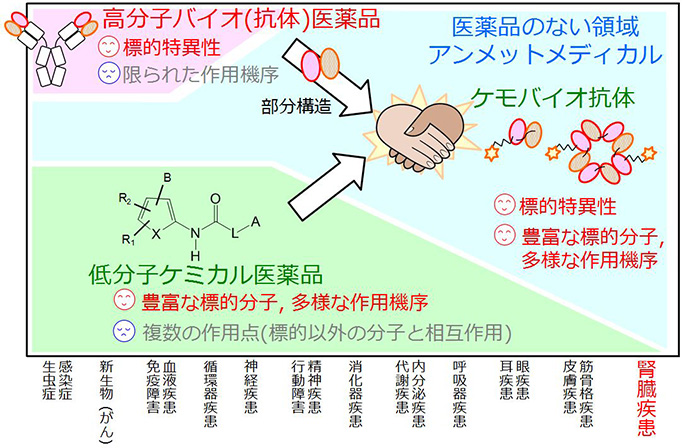
ヒトゲノムの解析から、医薬品の標的分子は1,500~2,000種存在すると現在推定されています。その中で既存の低分子(合成)医薬品の標的分子は500弱、バイオ医薬の主役である抗体医薬品の標的分子は50弱と見積もられており、薬物標的分子の半数以上が医薬品開発の目途が立っていないアンメットな疾患の標的分子として手つかずにあります。これは、低分子医薬と抗体医薬共に、利点と欠点を併せ持つためです。低分子医薬は、細胞内外の幅広い標的分子を対象として多様な作用機序が狙えるものの、低い標的特異性のため複数の作用点を持ってしまいオフターゲット作用や副作用を生じる場合が多く、また、薬物動態の制御が困難で特定の組織へ分布させることが難しい欠点があります。一方、抗体医薬は、標的特異性が高く特定組織へ集積させることができますが、利用領域が細胞外に限定され、作用も標的抗原との結合による中和活性と抗体依存性(ADCC)や補体依存性(CDC)の細胞障害作用に限られます。さらに、分子量が15万と巨大なため組織移行や細胞内への到達が限られ、目的細胞に特異的な表面抗原も極めて少ないことから、適応範囲が癌, 免疫, 感染症等の限定的なものになっています。そこで、私どもは、低分子医薬に抗体の必要最小限な構造を結合させて、幅広い標的分子を対象として多様な作用機序を設計できる低分子医薬に抗体レベルの高い標的特異性を付与することによって、アンメットな疾患の標的分子を対象にできる汎用性と実効性のある医薬品フォーマット(ケモバイオ抗体)を提案できると考えました。そして、本研究では、アンメット領域でも難関な代表的疾患である腎臓病疾患をモデルとして、その有用性を実証していきます。
慢性腎臓病(CKD)患者数は国内だけでも約580万人と推計され、グローバルな社会問題にもなっています。しかし、腎臓病を最初から狙って開発された医薬品はほとんどありません。また、腎障害はIgG型抗体のFc領域がFc受容体に結合することによって悪化するため、医薬品として抗体を利用・開発する場合は注意が必要です。その中で、近年、CKDの進展・悪化に、プラスミノーゲン活性化抑制因子であるPAI-1の高発現が中心的役割を果たしていることが分かってきており、私たちの研究グループではPAI-1を阻害できる低分子薬の開発に成功しています。そこで、私たちは、Fc領域を含まない低分子抗体を専門に研究を行ってきた研究者を中心に、医・薬・工学から蛋白質・抗体工学, 合成化学, 創薬科学, 腎臓薬理学の研究者が組織を組み、PAI-1阻害薬と腎臓上皮特異的な抗体群の標的結合断片(可変領域断片)を積木細工のブロックと捉えて、それらを組み合わせた医薬分子を設計します。そして、腎臓病をモデルとして、低分子医薬の作用機序を維持しつつ、抗体が持つ標的細胞特異性や良好な薬物動態が付与された第三の医薬フォーマットとしてケモバイオ抗体の有用性を実証したいと考えています。
<図1>現在の低分子・バイオ医薬で狙えない疾患領域の概念図
低分子医薬は、豊富な標的分子を対象とし、多様な作用機序を持つ利点がありますが、標的以外と相互作用もしやすい欠点があります。一方、バイオ医薬の代表である抗体医薬は、優れた標的特異性を持ちますが、作用が中和活性や細胞障害作用に限られ、薬物標的分子の半数以上がアンメットな疾患の標的分子として医薬分子の開発が進んでいません。私どもは、低分子医薬と抗体医薬の利点構造のみを融合させて、両者の利点を併せ持つケモバイオ抗体を提案し、低分子医薬の高機能化プロセスを開発します。
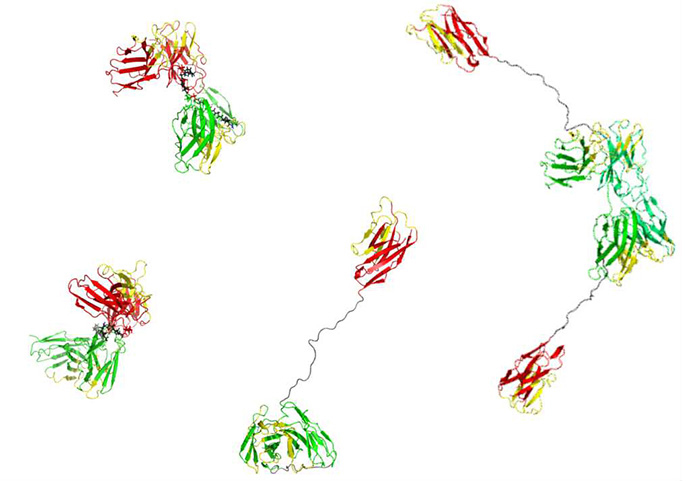
<図2>抗体の可変領域からなる様々な低分子抗体
本研究では、抗体の可変領域断片を組み合わせることで、腎疾患を悪化させるFc領域を持たず、かつ、IgG型抗体に負けない親和性を持つ低分子抗体を設計し、PAI-1阻害薬を腎臓組織へ選択的に運搬する分子を作製します。