プレスリリース 悪性腫瘍の増殖と薬剤耐性に関わるタンパク質のユニークな構造を世界で初めて解明
プレスリリース
慶應義塾大学医学部
国立研究開発法人日本医療研究開発機構(AMED)
国立研究開発法人科学技術振興機構(JST)
慶應義塾大学医学部医化学教室の加部泰明講師と末松誠教授(当時。現AMED理事長)らの研究グループは、難治性がんを含む多くの悪性腫瘍で高発現している膜結合性ヘムタンパク質(注1)であるPGRMC1の構造を解明することで、がん細胞が増殖を活性化する仕組みと、抗がん剤に対する耐性を獲得するメカニズムを世界で初めて明らかにしました。
PGRMC1はがん細胞の増殖に関与すると考えられていましたが、その機能の詳細は不明でした。本研究グループは、X線結晶構造解析(注2)を行いPGRMC1の詳細な分子構造を解析することで、このタンパク質が持つ特異な構造と、がん細胞を悪化させる仕組みを解明しました。
現在、種々のがん増殖機能を標的とした抗がん剤の開発は急速に進んでいますが、PGPMC1に結合してその機能を阻害する化合物が見つかれば、抗がん剤の開発が大きく前進すると期待できます。
本研究は、京都大学、大阪大学、北海道大学、(公財)サントリー生命科学財団との共同研究により、JST戦略的創造研究推進事業として推進された後、AMED革新的先端研究開発支援事業に引き継がれて行われました。
本研究成果は、2016年3月18日(米国東部時間)に英国科学誌Nature Communicationsのオンライン速報版で公開されます。
研究の背景
研究の内容
本研究では、京都大学医学部小林拓也准教授と共同でX線結晶構造解析を行い、PGRMC1の詳細な分子構造を世界に先駆けて明らかにしました。PGRMC1は、図1のようにタンパク質中のチロシン残基を介した珍しい様式でヘムと配位することが分かりました(注4)。この配位したヘムはタンパク質表面上に突出した構造を取っており、PGRMC1は分子中のアミノ酸残基をほとんど介さずに突出したヘム同士が重なり合った特異なヘム重合体構造を形成しています(図2)。生化学的な解析から、PGRMC1はヘムのない状態ではアポ体(注5)としてモノマー構造で存在しますが、ヘムと結合することにより2量体化することが明らかになりました。このようなタンパク質中のヘムを介した重合化は真核生物では初めて見いだされた新規の構造的制御の様式となります。生体内ガス分子であるCOは、がん細胞が抗がん剤、放射線治療、低酸素などにさらされると体内の酵素ヘムオキシゲナーゼが誘導されて増加します。このCOがPGRMC1上のヘムに結合するとヘム同士の重合が解離してPGRMC1の機能が消失することを見いだしました。
さらに、このようなPGRMC1の構造的制御とがん細胞における機能の関わりについて解析を進めた結果、PGRMC1はヘムにより重合化して、がん増殖に関わる上皮成長因子の受容体(EGFR)と会合して、これによるがん増殖シグナルを増強することを新たに見いだしました。また、重合化したPGRMC1は薬物代謝酵素であるシトクロムP450とも会合して抗がん剤の分解活性を増強して、がん細胞の薬剤耐性を促進することが分かりました。このように本研究の解析により、PGRMC1はがん細胞内のヘム濃度に応答して重合化することによって活性化し、がん細胞の増殖促進や抗がん剤耐性獲得に関与するという、ダイナミックな構造変換によって機能していることを明らかにしました(図3)。
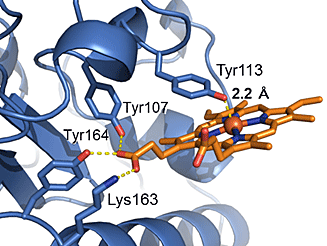 図1 PGRMC1のチロシン残基を介したヘムの配位様式
図1 PGRMC1のチロシン残基を介したヘムの配位様式
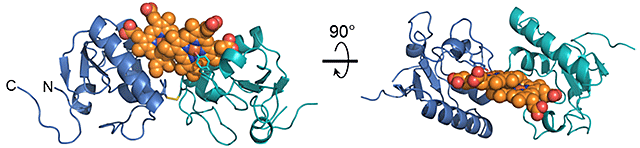 図2 ヘム結合によるPGRMC1の2量体構造の様式
図2 ヘム結合によるPGRMC1の2量体構造の様式
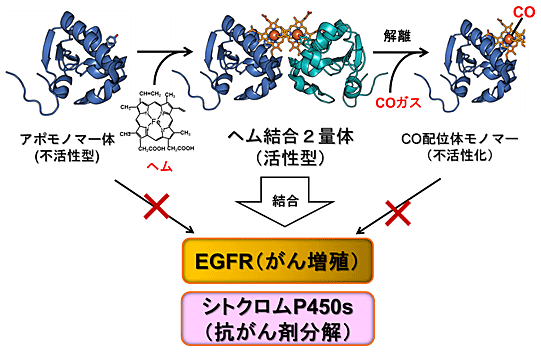 図3 PGRMC1の構造変換とがん細胞に関わる機能制御
図3 PGRMC1の構造変換とがん細胞に関わる機能制御
研究の意義・今後の展開
論文タイトル(和訳):Haem-dependent dimerization of PGRMC1/sigma-2 receptor facilitates cancer proliferation and chemoresistance(ヘムにより2量体を形成するPGRMC1/sigma-2受容体はがんの増殖と化学療法抵抗性を促進する)
著者名:Yasuaki Kabe, Takanori Nakane, Ikko Koike, Tatsuya Yamamoto, Yuki Sugiura, Erisa Harada, Kenji Sugase, Tatsuro Shimamura, Mitsuyo Ohmura, Kazumi Muraoka, Ayumi Yamamoto, Takeshi Uchida, So Iwata, Yuki Yamaguchi, Elena Krayukhina, Masanori Noda, Hiroshi Handa, Koichiro Ishimori, Susumu Uchiyama, Takuya Kobayashi and Makoto Suematsu
掲載誌:英国科学誌「Nature Communications」オンライン速報版
用語解説
- (注1)ヘム:
- ヘムは、鉄原子とポルフィリンから成る錯体であり、ヘモグロビンのようなヘム結合性タンパク質の補欠分子族として生理活性に重要な働きをします。
- (注2)X線結晶構造解析:
- 結晶に対してX線照射をして得られる回折像を解析することによってその分子構造を映し出す方法です。
- (注3)アフィニティ精製システム:
- 分子間の特異的な親和性を利用して目的とするタンパク質を結合、精製する手法です。今回はヘムを独自のカラムに固定化して、これに結合するタンパク質を精製しました。
- (注4)
- ヘモグロビンやシトクロムなどの一般的なヘムタンパク質は、タンパク質中のヒスチジンやシステイン残基を介してヘムと結合しており、チロシン残基の配位は珍しい様式となります。
- (注5)アポ体:
- タンパク質中にヘムなどの補欠分子族が結合していない状態をアポ体と呼びます。
お問い合わせ先
本発表資料のお問い合わせ
医化学教室 専任講師
加部 泰明(カベ ヤスアキ)
〒160-8582 東京都新宿区信濃町35番地
TEL:03-5363-3752 FAX:03-5363-3466
E-mail: ykabe“AT”z3.keio.jp
AMEDに関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 研究企画課
〒100-0004 東京都千代田区大手町1-7-1 読売新聞ビル
TEL:03-6870-2224 FAX:03-6870-2243
E-mail:kenkyuk-ask“AT”amed.go.jp
JSTの事業に関すること
国立研究開発法人科学技術振興機構(JST)
研究プロジェクト推進部
大山 健志(オオヤマ タケシ)
〒102-0076 東京都千代田区五番町7 K’s五番町
TEL:03-3512-3528 FAX:03-3222-2068
E-mail:eratowww“AT”jst.go.jp
本リリースの発信元
慶應義塾大学
信濃町キャンパス 総務課:谷口、吉岡
〒160-8582 東京都新宿区信濃町35
TEL:03-5363-3611 FAX:03-5363-3612
E-mail:med-koho“AT”adst.keio.ac.jp
国立研究開発法人科学技術振興機構
広報課
〒102-8666 東京都千代田区四番町5番地3
TEL:03-5214-8404 FAX:03-5214-8432
E-mail:jstkoho“AT”jst.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成28年3月22日
最終更新日 平成28年3月22日


