プレスリリース ドーパミン受容体の機能に新視点―ドーパミン受容体D1R・D2R発現抑制の視認知学習機能への影響―
プレスリリース
国立大学法人京都大学
脳科学研究戦略推進プログラム
革新的技術による脳機能ネットワークの全容解明プロジェクト
国立研究開発法人日本医療研究開発機構
要旨
理化学研究所(理研)脳科学総合研究センター高次脳機能分子解析チームの山森哲雄チームリーダー、高司雅史研究員らとライフサイエンス技術基盤研究センター生体機能評価研究チームの尾上浩隆チームリーダー、機能構築イメージングチームの横山ちひろ上級研究員、京都大学霊長類研究所高次脳機能分野の中村克樹教授、竹本篤史研究員らの共同研究グループは、大脳皮質の下にある線条体尾状核[1]のドーパミン[2]受容体D2R[2]を特異的に発現抑制すると視認知学習機能が低下するが、D1Rを特異的に発現抑制した場合には変化がない事を、マーモセットを用いて明らかにしました。
2014年に開始された「革新的技術による脳機能ネットワークの全容解明プロジェクト」では、新世界ザル[3]であるマーモセットをモデル動物として、霊長類脳の神経ネットワークの全容を細胞レベルで理解することを目標としています。しかし、現時点では有用なマーモセットの系統が整っていないため、特定の遺伝子の発現を時間的・空間的に変化させることで本来の遺伝子の機能を解明することは困難です。
そこで共同研究グループは、アデノ随伴ウイルス(AAV)ベクター[4]を用いて、RNA干渉により遺伝子発現を抑制するshRNAを霊長類であるマーモセットの線条体尾状核に導入し、脳内の特定の領域の遺伝子の操作を試みました。その結果、線条体尾状核のD1R[2]およびD2Rの発現の抑制に成功しました。この個体に視認知学習課題を行わせたところ、D2Rを発現抑制した個体は成績が悪化し、D1Rを抑制した個体には変化がみられませんでした。
今回の結果は、線条体尾状核の特定の遺伝子が認知学習へ関わることを示しています。また、運動機能で主要な役割を果たすと考えらえていたD1Rの発現を抑制しても変化がみられなかったことは、これまでの仮説と異なる結果で、認知機能におけるD1RとD2Rの役割に新たな問題を提起しています。
今後、共同研究グループが開発した霊長類の脳内の特定の領域の遺伝子を操作する技術とイメージング技術などを組み合わせることで、認知機能や学習機能といった複雑な脳機能の基盤となる神経ネットワークの理解が大きく進展すると期待できます。
本研究成果は、英国のオンライン科学雑誌『Scientific Reports』に11月2日付け:日本時間11月2日)に掲載されました。本研究は、日本医療研究開発機構の脳科学研究戦略推進プログラムおよび革新的技術による脳機能ネットワークの全容解明プロジェクトの一環として行われました。
※共同研究グループ
- 理化学研究所
- 分脳科学総合研究センター 高次脳機能分子解析チーム
チームリーダー 山森 哲雄(やまもり てつお)ライフサイエンス技術基盤研究センター
研究員 高司 雅史(たかじ まさふみ)
研究員 渡我部 昭哉(わたかべ あきや)
生命機能動的イメージング部門 イメージング基盤・応用グループ
生体機能評価研究チームチームリーダー 尾上 浩隆(おのえ ひろたか)機能構築イメージングチーム上級研究員 横山 ちひろ(よこやま ちひろ) - 京都大学 霊長類研究所 高次脳機能分野
-
教授 中村 克樹(なかむら かつき)
研究員 竹本 篤史(たけもと あつし) - 自治医科大学 分子病態治療研究センター 遺伝子治療研究部
-
教授 水上 浩明 (みずかみ ひろあき)
客員教授 小澤 敬也 (おざわ けいや)
背景
ヒトが持つ高次脳機能の基盤メカニズムを解明し、精神・神経疾患を克服するためには、ヒトが属する霊長類の脳をターゲットとした研究が不可欠です。2014年に開始された「革新的技術による脳機能ネットワークの全容解明プロジェクト」は新世界ザルであるマーモセットをモデル動物として、霊長類の高度に発達した脳の神経ネットワークの全容を細胞レベルで理解することを目標としています。同プロジェクトは、米国のBRAIN Initiative、EUのThe Human Brain Projectなどとともに、現在世界的に推進されている脳機能の統合的理解を目指す試みの中の一つに位置づけられています。
マーモセットはヒトと共通性を持った高度に発達した脳を持っています。小型で飼育が容易であり繁殖性に富むこともあって、遺伝子改変技術の開発も進展しています。このため、マーモセットは高次脳機能の研究に適したモデル動物であると考えられます。しかし、現時点では有用なマーモセットの系統が整っていません。このため、マウスを用いた研究で行われるような、特定の遺伝子の発現を時間的・空間的に変化させることで本来の遺伝子の機能を解明するという手法による研究は困難です。
研究手法と成果
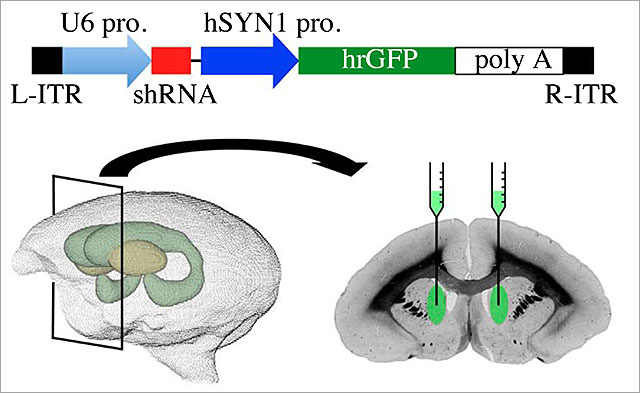 図1.注入したAAVの模式図と注入箇所
図1.注入したAAVの模式図と注入箇所
本研究で使用したAAVはU6プロモータでshRNAを発現して遺伝子発現抑制を行い、synapsinプロモータでhrGFPを発現させることでAAVが感染した細胞を同定できる(図上)。
下図はマーモセットの脳を左から見た図と断面図。内部の線条体を模式的に示した。緑色の部分が尾状核。断面図内の明るい緑の楕円で示した箇所にウイルスを注入している。
shRNAによる遺伝子発現の抑制効率を調べるため、AAV注入前・注入後のマーモセット同一個体におけるタンパク質発現量の変化を、陽電子放出断層撮影法(PET)[5]を用いて調べました。その結果、AAV注入箇所でのD1RまたはD2Rのタンパク質量の顕著な低下を確認しました(図2)。この発現抑制効果はin situハイブリダイゼーション法(ISH)[6]でも観察され、線条体尾状核の細胞レベルでもD1RとD2RのmRNA量が低下していることが分かりました。
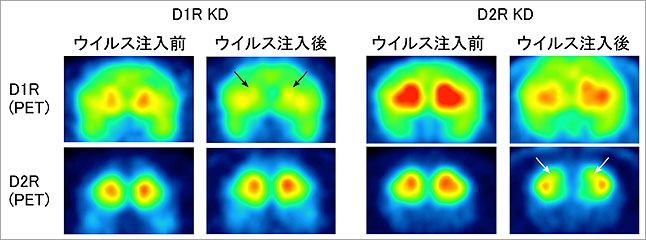
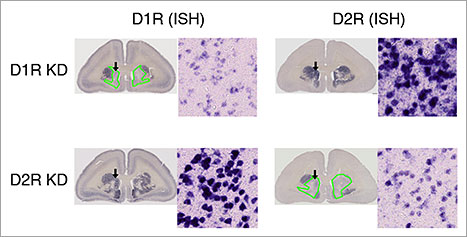
図2.PETとin situハイブリダイゼーション法による抑制効果の調査
A)PETによるタンパク質の分布
左図はD1R KDのタンパク質分布、右図はD2R KDのタンパク質の分布を示す。黒矢印、白矢印はタンパク質の発現量が低下している領域。AAVウイルス注入後は、D1R KDではD1Rタンパク質が、D2R KDではD2Rタンパク質の発現量が低下していることが分かる。
B)in situハイブリダイゼーション法によるmRNAの分布
上段はD1Rを発現抑制したマーモセット(D1R KD)のmRNAの分布、下段はD2Rを発現抑制したマーモセット(D2R KD)のmRNAの分布を示す。緑線で囲んだ箇所はshRNAによってmRNAの発現量が低下している領域。それぞれの黒矢印箇所の拡大図をみると、D1R KDではD1Rの発現量が低下(左上)、D2R KDではD2Rの発現量が低下(右下)していることが分かる。
D1RまたはD2Rの発現量を低下させたマーモセット(D1R KD:5頭、D2R KD:5頭、コントロール:4頭 計14頭)に、視認知学習課題である視覚弁別課題と逆転学習課題を行いました。視覚弁別課題はマーモセットに2枚の絵を見せて、正しい絵を選択出来れば報酬を与えます。逆転学習課題では視覚弁別課題を学習した後に、正解と不正解の絵を逆転させます。マーモセットはこれまで報酬がもらえていた絵を選んでも報酬がもらえなくなるため、報酬をもらうために反対の絵を選択することを学習します(図3)。この学習課題では、状況の変化に応じて行動を柔軟に変化できるかを調べます。
その結果、D1R KDではこれらの課題への影響が見られませんでしたが、D2R KDでは成績が悪化しました。
D1Rは運動機能で主要な役割を果たすと考えられています。DIRの線条体尾状核での発現量低下が、マーモセットにおいて特定の表現型を示さす、行動の変化が見られないという今回の結果は、認知機能におけるD1RとD2Rの機能理解に新たな問題を提起しています。
また、D2R KDでは、課題を途中で止めてしまうことが多くなり、また課題にかかる時間も長くなりました。この結果は、注意欠陥多動性障害[7]という集中力の不足や落ち着きがない、または衝動的に行動してしまうなどの要素が見られる発達障害の症状と類似していると考えられ、D2Rの注意欠陥多動性障害への関与を示唆しています。
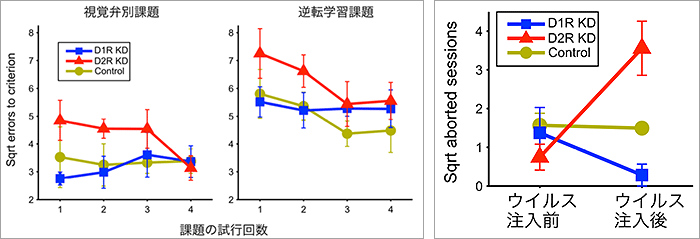 図3.D1RおよびD2R発現量を低下させた状態での視認知学習課題の結果
図3.D1RおよびD2R発現量を低下させた状態での視認知学習課題の結果
左図:各学習課題の「sqrt errors to criterion」=「マーモセットがそれぞれの試行で90%の正解を出すまでに間違えた回数の平方根の値」を示した。D2R KDでは、コントロールやD1R KDと比べて有意な成績の悪化が見られた。
右図:マーモセットが課題を途中で止めた回数の平方根の値を示した。D2R KDは他の個体に比べ課題を途中で止める回数が有意に多い。
今後の期待
日本は、遺伝子改変マーモセットの作製に世界で初めて成功しており、さまざまな精神・神経疾患モデルの作製が進められています。これらの疾患における神経ネットワーク変容を遺伝子レベルで解析することで、精神疾患発症のメカニズムに対する深い知見が得られ、新たな治療方法の開発につながる可能性があります。
論文情報
- Distinct roles for primate caudate dopamine D1 and D2 receptors in visual discrimination learning revealed using shRNA knockdown
- 著者名:
- Takaji, M#., Takemoto, A#., Yokoyama, C#., Watakabe, A., Mizukami, H., Ozawa, K., Onoe, H*., Nakamura, K*., Yamamori, T*.(#は同等貢献、*は責任著者)
- 雑誌:
- Scientific Reports
- DOI:
- 10.1038/srep35809
補足説明
- [1] 線条体尾状核
- 線条体とは大脳皮質の下にある構造体で、霊長類では尾状核と被殻と呼ばれる2つの構造体からなる。爬虫類で最もよく発達したが、哺乳類では、強化学習の主要な座とされ、依存症等と重要な関連がある。
- [2] ドーパミン、D1R、D2R
- ドーパミンとは神経伝達物質の1つで、ドーパミン受容体と結合して情報を伝達する。ドーパミン受容体の内、D1RとD2Rは線条体に豊富に発現している
- [3] 新世界ザル
- 広鼻猿類のサルで、南米に生息することから新世界ザル(マーモセットを含む)とも呼ばれる。マーモセットは、近年霊長類のモデル動物としての関心が高まっている。
- [4] アデノ随伴ウイルス(AAV)ベクター
- アデノ随伴ウイルスを用いたウイルスベクター。ウイルスベクターとはウイルスのゲノムを利用して任意の遺伝子を発現させる担体(ベクター)の総称で、ウイルスの感染性を無くしたものを用いる。
- [5] 陽電子放出断層撮影法(PET)
- 陽電子を放出する放射性同位体を薬などの分子に組み込んで個体に投与し、体内で崩壊して放出されるγ線を測定して分子の体内分布を見る方法。生きた個体でのタンパク質発現を確認することができる。PETはPositron Emission Tomographyの略。
- [6] in situハイブリダイゼーション法(ISH)
- 組織や細胞において、特定のDNAやmRNAの発現や分布を検出する方法。
- [7] 注意欠陥多動性障害
- 集中力の不足や落ち着きがない、または衝動的に行動してしまうなどの要素が見られる障害。本研究で、D2Rを発現抑制したマーモセットにみられた、課題を途中で止める、課題中の反応時間が増大する、という変化は、この障害との関連を示していると考えられる。
お問い合わせ先
発表者※研究内容については発表者にお問い合わせください
理化学研究所
脳科学総合研究センター 高次脳機能分子解析チーム
チームリーダー 山森 哲雄(やまもり てつお)
研究員 高司 雅史(たかじ まさふみ)
ライフサイエンス技術基盤研究センター
生命機能動的イメージング部門 イメージング基盤・応用グループ
生体機能評価研究チーム
チームリーダー 尾上 浩隆(おのえ ひろたか)
機能構築イメージングチーム
上級研究員 横山 ちひろ(よこやま ちひろ)
TEL:048-462-1111(山森、高司)、078-304-7121(尾上)
FAX:048-467-2539(山森、高司)、078-304-7123(尾上)
E-mail:tetsuo.yamamori“AT”riken.jp(山森)、masafumi.takaji“AT”riken.jp(高司)、hiro.onoe“AT”riken.jp(尾上)、chihiro“AT”riken.jp(横山)
京都大学 霊長類研究所 高次脳機能分野
教授 中村 克樹(なかむら かつき)
研究員 竹本 篤史(たけもと あつし)
TEL:0568-63-0562 FAX:0568-63--563
E-mail:nakamura.katsuki.4z“AT”kyoto-u.ac.jp(中村)、takemoto.atsushi.2x“AT”kyoto-u.ac.jp(竹本)
機関窓口
理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
E-mail:ex-press“AT”riken.jp
日本医療研究開発機構 脳と心の研究課
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2222 FAX:03-6870-2244
E-mail:brain-pm“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成28年11月8日
最終更新日 平成28年11月8日


