プレスリリース 遺伝子診断ネットワーク「LC-SCRUM-Japan」における研究成果により、ROS1融合遺伝子陽性の肺がんに対する治療薬と診断薬が保険適用として承認
プレスリリース
国立研究開発法人日本医療研究開発機構
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)東病院(病院長:大津 敦)では、呼吸器内科長後藤功一が研究代表者となり、多施設共同研究として全国肺がん遺伝子診断ネットワーク「LC-SCRUM-Japan」を活用した研究が実施されてきました。当該研究の成果および治療開発への貢献によって、ROS1融合遺伝子陽性の切除不能な進行・再発非小細胞肺がん(以下、ROS1肺がん)に対する治療薬として、分子標的薬クリゾチニブの適応拡大が承認されました。併せて、ROS1融合遺伝子検出のための体外診断用医薬品(ROS1融合遺伝子検出キット)が、この治療におけるコンパニオン診断薬として承認されました。
LC-SCRUM-Japanには、これまでに全国240以上の診療施設が参加し、4000例を超える肺がん患者さんの遺伝子スクリーニングが行われました。2013年9月から開始されたROS1肺がんに対するクリゾチニブの承認申請を目的に行われた臨床試験には、LC-SCRUM-Japanの遺伝子スクリーニングで見つかったROS1肺がん患者さんが数多く登録され、またその診断薬の開発にあたっては、これまでの遺伝子スクリーニングのデータが有効に活用されました。ROS1肺がんは非小細胞肺がんのわずか1~2%に存在する希少ながんにも関わらず、臨床試験の開始からわずか4年で治療薬、および診断薬の承認に至ったことには、LC-SCRUM-Japan参加全施設が協力して行った大規模な遺伝子スクリーニングが大きく貢献しています。
これにより、わが国のROS1肺がんの患者さんに有効な治療薬を届けることが可能となり、今後、患者さんの長期生存につながることが期待されます。
研究の背景
日本における死因の第1位はがんであり、その中で肺がんはがん死亡原因として最多です。現在、日本で年間に約13万人が肺がんを発症し、7万人を超える患者さんが肺がんで死亡しています。肺がんの約85%を占める非小細胞肺がんにおいては、約2/3の患者さんが手術不能の進行がんとして発見され、抗がん剤による薬物治療や放射線治療などを受けています。しかしながら、その治療効果は充分ではなく、より有効な新しい治療法の開発が必要とされています。
そのような中で、近年の遺伝子解析技術の進歩により、肺がん発症の原因となる様々な遺伝子変化が相次いで発見され、これらの遺伝子変化を有する肺がんには、各々対応する分子標的薬の治療効果が非常に高いことがわかってきました。これまでに、日本人の非小細胞肺がんの約30%を占める、EGFRという遺伝子に変化がある肺がん(EGFR遺伝子変異陽性肺がん)に対しては、EGFRを標的とする治療薬が高い治療効果を示し、また、非小細胞肺がんの約5%に存在するALKという遺伝子に変化がある肺がん(ALK融合遺伝子陽性肺がん)に対しては、ALKを標的とする治療薬の効果が高いことが明らかになっています。
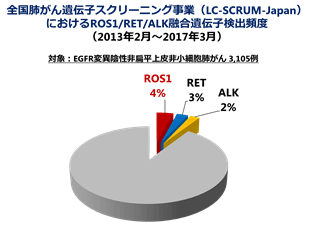
2007年に、ROS1遺伝子の変化(ROS1融合遺伝子)が肺がんに存在することが分かり、EGFRやALKに次ぐ肺がんの治療標的として注目されましたが、このROS1融合遺伝子をもつ肺がん(ROS1肺がん)の割合は、非小細胞肺がんの1~2%と極めて希少であるため、治療開発のための臨床試験を行うのに充分な数の患者さんを集めることが難しいという問題がありました。
その後、ROS1以外にも、希少な遺伝子変化をもつ肺がんがいくつか存在することがわかってきました。そこで、たとえ希少であってもその病気で苦しんでいる患者さんが存在するのであれば、有効な治療薬の開発に挑戦するべきであるという考えのもと、この希少な肺がんを全国でスクリーニングして臨床試験につなげる目的で、全国規模の肺がん遺伝子診断ネットワーク「LC-SCRUM-Japan」が2013年に組織されました。
研究概要
LC-SCRUM-Japanでは、全国の肺がん診療施設の参加を募り、患者さんの同意を得たうえで、遺伝子検査のために肺がんのサンプルを提出してもらい、提出されたサンプルを用いてROS1を含む複数の希少な遺伝子変化の有無を無料で調べ、遺伝子変化が特定された患者さんには、該当する分子標的薬の臨床試験を紹介し、治療開発につなげています。
ROS1肺がんについては、日本を含む東アジア4か国でROS1を標的とする治療薬クリゾチニブの臨床試験が2013年から開始されたため、LC-SCRUM-Japanで特定されたROS1肺がん患者さんがこの臨床試験に登録されました。この臨床試験は、わが国では、国立がん研究センター(中央病院、東病院)、がん研究会有明病院、東北大学医学部附属病院、静岡県立静岡がんセンター、愛知県がんセンター、近畿大学医学部附属病院、大阪市立総合医療センター、兵庫県立がんセンター、国立病院機構四国がんセンター、国立病院機構九州がんセンターで実施されました。
研究成果
LC-SCRUM-Japanには、2017年3月現在、全国47都道府県から240以上の施設が参加し、4000例を超える肺がん患者さんが登録されました。
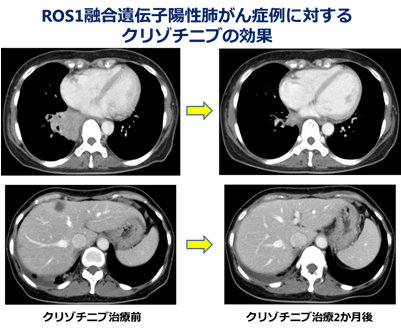
ROS1肺がんに対するクリゾチニブの臨床試験には、2015年3月までにLC-SCRUM-Japanに登録され、ROS1肺がんと特定された61例の患者さんのうち、26例が日本から登録されました。試験全体では、合計127例のROS1肺がん患者さんが登録され、クリゾチニブ治療の奏効割合は69%と良好な成績が得られました。
この試験結果をもとに、わが国では、2017年5月にROS1肺がんに対する治療薬としてクリゾチニブの適応拡大が承認されました。併せて、ROS1融合遺伝子検出のための体外診断用医薬品(「OncoGuide AmoyDx ROS1融合遺伝子検出キット」)が、ROS1肺がんに対するクリゾチニブ治療のコンパニオン診断薬として承認されました。この診断薬開発においても、LC-SCRUM-JapanにおけるROS1融合遺伝子検査のデータが活用され、診断薬承認に大きく貢献しました。
今後の展望
今回の治療薬と診断薬の承認により、全国のROS1肺がんの患者さんに有効な治療薬を届けることができるようになりました。これまでの臨床試験の成績からは、すでに承認されているEGFRやALKを標的とする治療に匹敵する、もしくはそれ以上の有効性を期待できるものと考えられ、肺がん患者さんの長期生存、あるいはQOLの向上や維持に大きく寄与するものと思われます。
また、今回の治療開発は、臨床試験開始からわずか4年という速さで治療薬と診断薬の承認に至りました。このことは、今後のROS1以外の希少肺がんの治療開発において勇気づけられる事例であり、肺がんにおける最適医療の構築を促進するものと考えます。
LC-SCRUM-Japanでは、引き続き、全国の参加施設や肺がん患者さんの協力のもと、肺がんの最適医療の開発に挑戦していきます。
研究費
お問い合わせ先
報道関係のお問い合わせ
企画戦略局 広報企画室(柏キャンパス)
TEL:04-7134-6945(直通)TEL:04-7133-1111(代表)
E-mail:ncc-admin“AT”ncc.go.jp
革新的がん医療実用化研究事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 がん研究課
〒100-0004 東京都千代田区大手町一丁目7番1号
TEL:03-6870-2221
E-mail:cancer“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 平成29年8月18日
最終更新日 平成29年8月18日


