反復配列RNAの異常発現が膵癌発生を促進するメカニズムをマウスで確認
プレスリリース
東京大学医学部附属病院
国立研究開発法人日本医療研究開発機構
発表者
岸川 孝弘(東京大学医学部附属病院 消化器内科(留学中))
大塚 基之(東京大学医学部附属病院 消化器内科 講師)
小池 和彦(東京大学医学部附属病院 消化器内科/東京大学大学院医学系研究科 内科学専攻 消化器内科学 教授)
発表のポイント
- 反復配列RNAと呼ばれる、タンパク質情報を持たないRNAが異常発現すると、DNAの変異を蓄積させて膵臓の前癌病態形成が促進されることを動物モデルで確認しました。
- これまでは機能を持たないと考えられ、着目されることの少なかった反復配列RNAに、「癌化促進」という重大な機能があることを示しました。
- 癌になる前段階から発現してくる反復配列RNAの機能や発現メカニズムをさらに解明することによって「発癌を予防する医療」への展望を拓くと期待されます。
発表概要
膵癌は抗癌治療の発展した現在においても予後不良であり、難治癌の代表的存在として知られています。この発癌の過程において、単純な塩基配列の繰り返しで構成される「反復配列RNA」と呼ばれるタンパク質情報を持たないRNA(ノンコーディングRNA)が、癌になる前段階から異常に発現していることが明らかになってきました。東京大学医学部附属病院 消化器内科の岸川 孝弘(留学中)、大塚 基之講師、小池 和彦教授らの研究グループは、以前、マウスの膵臓の良性腫瘍から樹立した細胞を用いて研究を行い、これまで機能を持たないと考えられてきた反復配列RNAの一種であるMajSAT RNAと呼ばれる「サテライト配列(注1)由来のRNA」がYBX1というタンパク質と結合すると、YBX1のもつDNAダメージ修復機能を阻害して、突然変異の蓄積を促進、細胞を癌化させることを見出しました(Kishikawa et al. Nat Commun 2016;7:13006 [※1])。今回は、新たにMajSAT RNAを恒常的に発現するマウスを作製し、このマウスで膵臓に炎症を惹起したところ、膵組織内のDNAダメージが増え、さらに膵特異的Kras遺伝子(注2)変異マウスとの交配で膵臓の前癌病態の形成が促進されることを確認しました。これらの結果は、以前に、細胞レベルの検討で見いだした、反復配列RNAが「細胞内変異原」として機能し、発癌プロセスを進める重大な働きをしていることを生体でも確認したことになり、発癌機序の解明、発癌予防という観点からも重要な成果であるといえます。本研究成果は、日本時間5月10日にMolecular Cancer Research(Online First)にて発表されます。なお、本研究は、日本医療研究開発機構(AMED)次世代がん医療創生研究事業「次世代の診断・治療・予防法の創生をめざした膵がん特異的リピートRNAの新規探索と応用」、「血中反復配列RNAの高感度測定による癌の早期診断と囲い込み法の開発」および文部科学省科学研究費補助金等の支援により行われました。
発表内容
研究の背景
膵癌は、抗癌治療に著しい革新の見られる現代においても いまだ難治癌の代表として知られており、しかもその罹患者数は年間約34,000人と増加の一途をたどっています。膵癌のリスク因子は、肺癌や胃癌、肝臓癌などとは異なり、はっきり分かっているものが少なく、癌化を早期に診断し、あるいは予防するためには、発癌のメカニズムについての解明が急務と考えられます。本研究グループは、サテライト配列という、染色体のセントロメアという領域に集中して存在し、通常の細胞では強く転写が抑制されている領域からの転写産物(反復配列RNA)が、癌、特に膵癌において異常に増加していることに着目し新しい発癌機序を解明してきました。すなわち、癌化の初期段階で発現してくるmajor satellite RNA(MajSAT RNA)と呼ばれる反復配列RNAの存在によって、酸化ストレスなどで細胞に日常的に加わるDNAダメージからの回復が遅延し、結果的にゲノムやミトコンドリアDNAの突然変異が蓄積され、その後の細胞癌化を促進していることを以前に示しました(Kishikawa et al. Nat Commun 2016;7:13006)。今回は、これら細胞レベルの研究で見いだした癌化機構が実際に生体(in vivo)でも起きているのかを検証するため、MajSAT RNAを恒常的に発現する遺伝子改変マウスを作製して検討を加えました。
研究内容
まず、遺伝子導入によってMajSAT RNAを全身で恒常的に発現するトランスジェニックマウスを作製しました。このマウスは通常の飼育状態では膵臓をはじめとする臓器に慢性的な炎症が惹起され、腋窩や胸腺などにリンパ腫の形成が見られました。次に、膵臓特異的に炎症を惹起する化学物質を与えて検討をしたところ、培養細胞での検討結果と同様に、炎症によって誘導されるYBX1タンパク質の核内移行が阻害され、膵細胞のDNA障害が蓄積していることが判りました。
次に、膵上皮特異的にKras変異が導入され恒常的にKrasタンパク質が活性化しているマウスとの交配による変化を検討しました。その結果、変異型Kras単独のマウス(PK)でも見られる膵前癌病態であるPanIN(注3)が、変異型KrasとMajSAT RNAを両方発現するマウス(PKM)において形成が早まり、かつ、その数も増えることが判りました(図1)。また、PKMマウスは PKマウスに比べて生命予後が短く早期に致死的になることが示されました(図2)。
これらの結果は以前に培養細胞でみいだした、癌化の初期段階で発現してくるMajSAT RNAの存在によって、種々のストレスで細胞に日常的に加わるDNAダメージからの回復が遅延し、結果的にゲノムやミトコンドリアDNAの変異が蓄積されて、その後の細胞癌化を促進しているという現象を、マウスを用いたin vivo(生体)実験でも確認したことになります。
社会的意義・今後の予定
本研究の意義は、癌化過程の早期から発現してくる反復配列RNAが、いわば「細胞内変異原」として機能し、発癌プロセスを進める機構として重大な働きをしていることが生体(in vivo )でも示されたことになります(図3)。膵癌はKras遺伝子の変異が最初に起こり、その後さまざまな遺伝子変異が蓄積して発癌にいたると考えられていますが、反復配列RNAが発現してくることで前癌病態への移行や癌化が促進されるのであれば、発癌予防という観点からも反復配列RNAの機能を解明していくことは重要であるといえます。また、膵前癌病態からの反復配列RNAの存在は、本発表者らがこれまでに、膵癌およびその前癌病態の患者さんで血清中に流れる微量な反復配列RNAの量を測定することによって早期診断ができることを報告したように(Kishikawa T, Otsuka M, Koike K et al. JCI Insight 2016;1(8):e86646 [※2])、癌を早期に見つけるためのバイオマーカーとしても応用できる可能性があります。
今後は、培養細胞および今回のマウス組織で得られたデータをもとに、ヒトへの応用、特に発癌抑止医療の確立を目指した制御機構の解明を進めていきたいと考えています。
発表雑誌
- 雑誌名:
- Molecular Cancer Research(Online First)
- 論文タイトル:
- Satellite RNA Increases DNA Damage and Accelerates Tumor Formation in Mouse Models of Pancreatic Cancer
- 著者:
- 岸川 孝弘、大塚 基之*、鈴木 辰典、清宮 崇博、關場 一磨、石橋 嶺、田中 恵理、大野 元子、山上 まり、小池 和彦(* 責任著者)
- DOI番号:
- 10.1158/1541-7786.MCR-18-0139
用語解説
- (注1)サテライト配列:
- ゲノム上には単純な塩基配列が繰り返し出現する反復配列と呼ばれる領域が幅広く存在し、ヒトでは全ゲノムの約半分が反復配列で占められると言われている。その中でセントロメアと呼ばれる染色体の中心部分に高度に反復して集中的に存在する反復配列はサテライト配列と呼ばれ、ヒトではAlpha satelliteやHSATII、マウスではminor satelliteやmajor satelliteなどと呼ばれる複数の配列パターンが知られている。
- (注2)Kras遺伝子:
- 細胞増殖のスイッチ機能を持つタンパク質で、特定の領域に突然変異を来すと増殖に抑制が効かなくなる。代表的ながん遺伝子の一つで、膵癌においては特に変異の割合が高く、ヒトの膵癌で90%以上に変異が見られるだけでなく、前癌状態とされるPanINでも半数近くに変異を認める。また、遺伝子改変によりKras遺伝子に変異を起こしたマウスは膵臓にヒトのPanINに類似した腺腫様腫瘍を形成する。
- (注3)PanIN:
- pancreatic intraepithelial neoplasiaの略。膵癌の前駆病変とされる微小な膵管上皮内良性腫瘍で、進行とともに徐々に異形度が強くなり癌化に至ると考えられている。大腸癌で提唱されている正常→腺腫→癌という発癌プロセス(adenoma-carcinoma sequence)と同じように遺伝子変異が蓄積することによって癌化するモデルの一つと考えられている。
添付資料
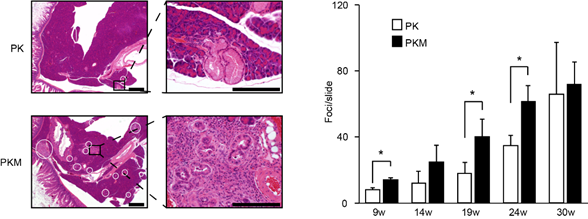
左:各マウスの膵組織のHE染色像。白丸が発生したPanINを示す。
右:週齢ごとのPanINの発生数の比較。若週齢のPKMマウスにおいて有意に発生数が増加している。
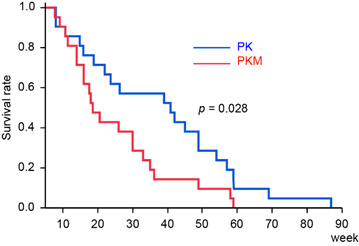
図2 PKマウスとPKMマウスの生存比較曲線
PKMマウスにおいて有意に予後が悪化していた。
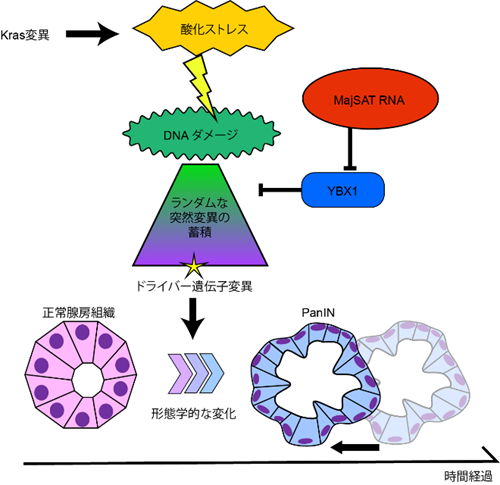
酸化ストレスにより日常的に惹起されるDNAダメージをYBX1タンパク質が修復するが、 MajSAT RNAがこの機能を阻害することによって、修復されなかったDNAがランダムな突然変異として蓄積する。結果的に発癌を促進するドライバー遺伝子が変異する機会が増え、発癌のプロセスを加速させることが推定される。
問い合わせ先
研究内容に関するお問い合わせ先
東京大学医学部附属病院 消化器内科
講師 大塚 基之(おおつか もとゆき)
TEL:03-5800-8812
E-mail: otsukamo-tky"AT"umin.ac.jp
取材に関するお問い合わせ先
東京大学医学部附属病院 パブリック・リレーションセンター
担当:渡部、小岩井
TEL:03-5800-9188(直通)
E-mail:pr"AT"adm.h.u-tokyo.ac.jp
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 がん研究課
次世代がん医療創生研究事業担当
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2221 FAX:03-6870-2244
E-mail:cancer"AT"amed.go.jp
※E-mailは上記アドレス"AT"の部分を@に変えてください。
関連リンク
掲載日 平成30年5月10日
最終更新日 平成30年5月10日


