プレスリリース 細胞内ストレス応答を抑える分子の作用機構―翻訳開始因子の阻害型構造への変化を抑制する医薬品候補分子―
プレスリリース
理化学研究所
日本医療研究開発機構
理化学研究所(理研)生命機能科学研究センター翻訳構造解析研究チームの伊藤拓宏チームリーダー、柏木一宏研究員らの国際共同研究グループ※は、「ISRIB[1]」と呼ばれる分子が細胞内のストレス応答[2]を抑える仕組みを解明しました。
本研究成果は、ISRIBの作用機構をベースとした神経変性疾患[3]に対する新たな治療薬の開発へ貢献すると期待できます。
細胞は、変性タンパク質の蓄積といったストレスにさらされると、「統合的ストレス応答(ISR)[4]」と呼ばれる経路が働き、タンパク質の合成反応である翻訳を停止してストレスに対処します。一方、ISR経路が慢性的に働くと、神経細胞死を引き起こし、プリオン病やアルツハイマー型認知症などのさまざまな神経変性疾患に関与することが知られています。低分子化合物であるISRIBは、翻訳開始因子[5]「eIF2B[5]」に結合することで、ISR経路を抑制する(翻訳の停止を解除する)作用があり、脳損傷モデルマウスにおいてISRIBの投与による神経保護効果が報告されています。
今回、国際共同研究グループは、ISRIBの分子レベルでの作用機構について解析を行いました。その結果、ISRIBは、翻訳開始を促進するeIF2Bの活性型構造に結合することで、ストレス環境下で生成されるeIF2Bの阻害因子「リン酸化[6]eIF2[5]」によるeIF2Bの阻害型構造への変化を妨げ、ひいてはISR経路の進行を抑制することが明らかになりました。
本研究は、科学雑誌『Molecular Cell』の掲載に先立ち、オンライン版(2020年11月20日付:日本時間2020年11月21日)に掲載されます。
- ※国際共同研究グループ
- 理化学研究所 生命機能科学研究センター
翻訳構造解析研究チーム
チームリーダー 伊藤拓宏(いとうたくひろ)
研究員 柏木一宏(かしわぎかずひろ)
技師 坂本恵香(さかもとあやこ)
技師 西本まどか(にしもとまどか)
タンパク質機能・構造研究チーム
チームリーダー 白水美香子(しろうずみかこ)
創薬タンパク質解析基盤ユニット
テクニカルスタッフⅠ 米持まゆ美(よねもちまゆみ)
ケンブリッジ大学 Cambridge Institute for Medical Research
教授 デービッド・ロン(David Ron)
研究員 アリサ・ザイリャノバ(Alisa F. Zyryanova)
研究員 クラウディア・ラト(Claudia Rato)
研究員 ヘザー・ハーディング(Heather P. Harding)
研究員 アナ・クレスピロ―カサド(Ana Crespillo-Casado)
研究員 ルーク・ペレーラ(Luke A. Perera) - 研究支援
- 本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(B)「複合体間の動的な相互作用による翻訳制御の構造基盤(研究代表者:伊藤拓宏)」、同若手研究「ストレス環境における翻訳開始因子eIF2Bの活性阻害機構の解明(研究代表者:柏木一宏)」、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業創薬等先端技術支援基盤プラットフォーム(BINDS)「統合的構造解析に向けた高難度複合体の生産支援と高度化(研究代表者:白水美香子)」、「クライオ電顕による細胞内ネイティブ複合体構造解析(研究代表者:吉川雅英)」による支援を受けて行われました。
背景
ヒトを含む真核生物の細胞では、熱ショック、活性酸素、高浸透圧、紫外線、放射線、ウイルス感染などのさまざまなストレスに対して、共通したストレス応答経路が働くことが知られており、その経路は「統合的ストレス応答(ISR)経路」と呼ばれています。ISR経路は、ストレスへの対処や環境変化への適応に重要な役割を果たします。一方、さまざまな神経変性疾患では、ISR経路が慢性的に働いてしまう結果、神経細胞死が引き起こされていることが知られています。
「ISRIB」は、ISR経路を抑制する低分子化合物のスクリーニングから発見された分子で、脳損傷モデルマウスなどでは、ISRIBの投与によって神経保護効果が見られることが報告されています注1)。ISRIBは、細胞内で翻訳開始因子「eIF2B」に結合します。eIF2Bは、タンパク質の合成(翻訳)に際して働くタンパク質複合体であり、ISR経路の中核をなす因子です。通常の環境では、eIF2Bは別の翻訳開始因子「eIF2」と結合してeIF2を活性化し、翻訳開始を促進する役割を果たします(図1)。このとき、eIF2はeIF2Bにとって反応基質となります。
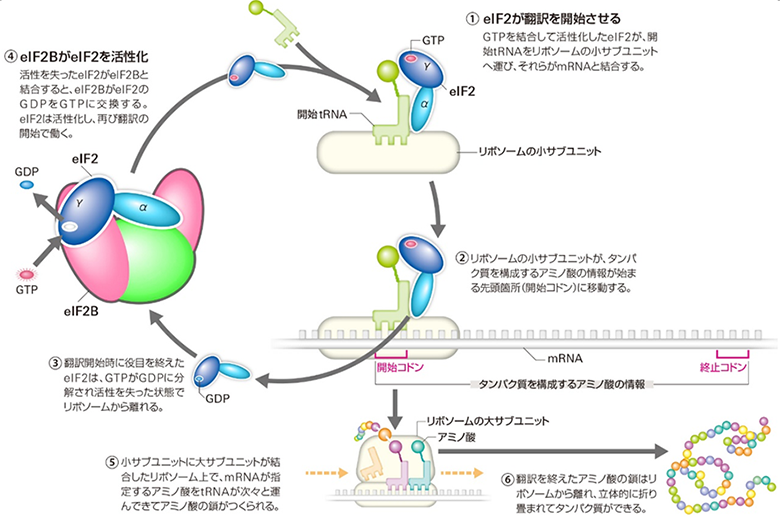
一方、ストレス環境下ではeIF2がリン酸化され、リン酸化eIF2が通常とは異なる向きでeIF2Bに結合することで、eIF2Bによる非リン酸化eIF2の活性化を阻害します(活性阻害効果)。つまり、リン酸化eIF2は、eIF2Bにとって阻害因子として働きます。その結果、ISR経路の下流のさまざまな変化が引き起こされます注2)。
eIF2Bは、5種類のサブユニット[7]が2個ずつ計10個のサブユニットから構成される十量体です。ISRIBは、eIF2Bのサブユニットをまたぐように結合し、eIF2Bの十量体構造の形成を促進します。そのため、これまでISRIBはサブユニット間相互作用を安定化し、eIF2を活性化させる十量体型eIF2Bの細胞内の総量を増加させることで、リン酸化eIF2によるeIF2Bの活性阻害効果を緩和していると考えられていました。しかし、ISRIBによるeIF2B十量体構造の安定化が、ISR経路を抑制するための主要な機構である証拠はありませんでした。
注1)A. Chou, et al., Inhibition of the integrated stress response reverses cognitive deficits after traumatic brain injury. Proc Natl Acad Sci USA, 114, E6420-E6426 (2017).
注2)2019年5月3日理化学研究所プレスリリース「ストレスでタンパク質合成が止まる仕組み」
研究手法と成果
国際共同研究グループは、ISRIBがeIF2Bの活性やISR経路に与える影響について解析を行いました。その結果、ISRIBがeIF2Bの活性を高める効果はISRIB単独ではほとんど見られず、阻害因子であるリン酸化eIF2によりeIF2Bの活性が阻害されるときにだけ、その効果が観察されることが判明しました。こうした現象は、ISRIBが単にeIF2Bの十量体形成を促進するという従来の説明では解釈できず、ISRIBにはリン酸化eIF2による阻害に対抗するような他の機構が存在することが示唆されました。
そこで、ISRIBの作用機構を解明するため、ISRIBがeIF2Bに結合する部位(結合ポケット)の構造が、リン酸化eIF2存在下でどのように変化するかなどを詳しく調べました。伊藤拓宏チームリーダーらは先行研究において、クライオ電子顕微鏡法[8]を用いた立体構造解析により、eIF2Bとリン酸化eIF2との複合体構造を報告しています注2)。今回、さらに測定データを追加し詳細な解析を行うことで、eIF2B-リン酸化eIF2複合体が取り得る複数の状態の構造、そしてeIF2B単体の構造を明らかにしました。
そして、これらの構造と他グループによって報告された構造との比較を行ったところ、一つのeIF2Bに対し2分子のリン酸化eIF2が結合した構造でのみ、eIF2Bのサブユニットの位置関係に変化が生じていることが分かりました(図2)。eIF2Bに対し2分子のリン酸化eIF2が結合した構造では、基質である非リン酸化eIF2の結合に関与するサブユニット(eIF2Bのβサブユニットとδサブユニット)間の位置関係が変化し、そのため非リン酸化eIF2がeIF2Bに結合しにくい阻害状態になっていると考えられます(図2B)。またこの変化は、eIF2Bのサブユニット間をまたぐように位置しているISRIBの結合ポケットの形状にも影響を及ぼしており、リン酸化eIF2の結合時にはISRIBはeIF2Bに結合しにくいことが示唆されました(図2C)。逆に、ISRIBはeIF2Bの活性型構造に構造変化を伴わずに結合するため、ISRIBの結合時にはリン酸化eIF2が結合しにくいといった、eIF2Bへの結合を互いに妨げ合う関係にあることが示唆されました。こうしたリン酸化eIF2の結合とISRIBの結合との拮抗状態は、試験管内で分子間相互作用を計測する生化学的実験によっても確認されました。
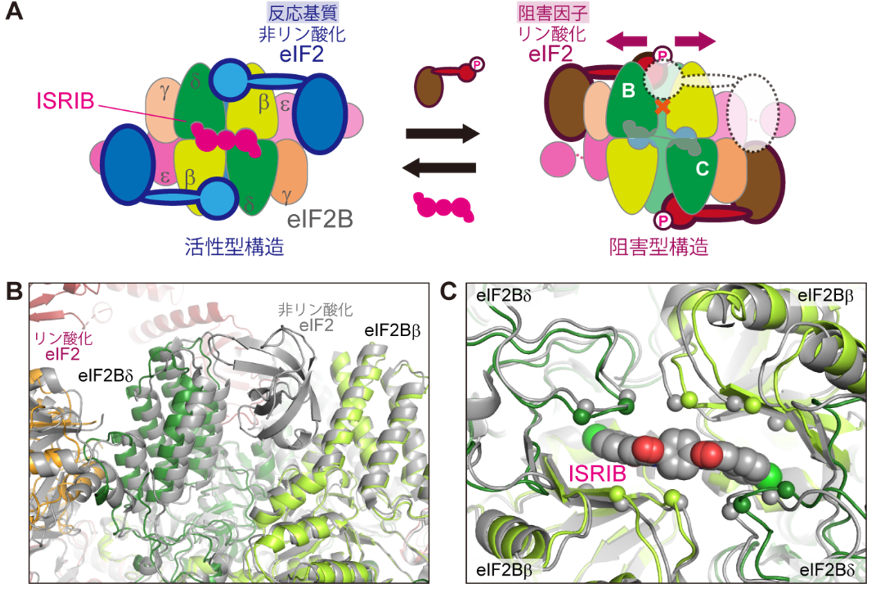
(B)リン酸化eIF2の結合に伴う、非リン酸化eIF2結合面の変化(A右図に示したBのあたり)。非リン酸化eIF2結合面を形成しているeIF2Bのβサブユニットとδサブユニットが離れるような位置関係の変化が生じており、非リン酸化eIF2が結合しにくい状態となっている。eIF2B-リン酸化eIF2複合体は(A)右図と同じ色で、eIF2B-非リン酸化eIF2-ISRIB複合体が灰色で示されている。
(C)リン酸化eIF2の結合時のISRIB結合ポケットの変化(A右図に示したCのあたり)。ISRIBの結合に関与しているeIF2Bのβサブユニットとδサブユニットのアミノ酸残基を球で示している。リン酸化eIF2の結合に伴って、これらの残基の位置に変化が生じており、リン酸化eIF2とISRIBが同時にeIF2Bに結合することはできない。
これらのことから、ISRIBはeIF2Bのサブユニット間相互作用の安定化だけでなく、リン酸化eIF2との結合を阻害することでeIF2Bの活性低下を防ぎ、その結果ISR経路を抑制するという新たな機構を提唱することができました。
今後の期待
本研究から、ISRIBはストレス環境下でのリン酸化eIF2との結合に伴うeIF2Bの構造変化を防ぐことで、細胞のストレス応答を抑制するという新たな作用機構が解明されました。ISRIBの正確な作用機構の理解は、さまざまな神経変性疾患に対する新たな治療薬の開発へ貢献すると期待できます。
また、リン酸化eIF2の結合によってISRIB結合ポケットの形状が変化するという新たな知見から、形状変化したポケットに対して選択的に結合する低分子化合物により、ストレス応答を人為的に持続させられる可能性が考えられます。これは例えば、ウイルス感染のストレスにさらされた細胞の細胞死を誘導するような新たな抗ウイルス薬を開発できる可能性を示すものです。
論文情報
- タイトル
- ISRIB blunts the integrated stress response by allosterically antagonising the inhibitory effect of phosphorylated eIF2 on eIF2B
- 著者名
- Alisa F. Zyryanova, Kazuhiro Kashiwagi, Claudia Rato, Heather P. Harding, Ana Crespillo-Casado, Luke A. Perera, Ayako Sakamoto, Madoka Nishimoto, Mayumi Yonemochi, Mikako Shirouzu, Takuhiro Ito, David Ron
- 雑誌
- Molecular Cell
- DOI
- 10.1016/j.molcel.2020.10.031
補足説明
- [1]ISRIB
- カリフォルニア大学サンフランシスコ校のWalter教授らのグループにより、統合的ストレス応答を抑制する低分子化合物のスクリーニングにより単離された分子量451の小分子。eIF2のリン酸化に対抗するIC50(半数阻害濃度)が5nMという高い活性を持ちながら、マウスへの毒性は非常に低い。アルツハイマー型認知症や外傷性脳損傷などの脳神経疾患に対する治療薬として期待されている。Integrated Stress Response InhiBitorの略。
- [2]ストレス応答
- 熱ショック、活性酸素、高浸透圧、紫外線、放射線、ウイルス感染など、環境からのストレスに対して細胞が示す反応。細胞の恒常性維持に働くほか、細胞死を誘導する場合もある。
- [3]神経変性疾患
- 神経細胞の変性・脱落を伴う病気の総称。異常なタンパク質の凝集などを伴い、神経細胞が損傷するために起きると考えられている。前頭側頭葉変性症(FTLD)、アルツハイマー型認知症、パーキンソン病、プリオン病、筋萎縮性側索硬化症(ALS)などが知られている。
- [4]統合的ストレス応答(ISR)
- ストレスにさらされた細胞は、タンパク質の翻訳を全体的に抑制することにより細胞への負荷を減らし、その一方で一部のタンパク質の翻訳を選択的に誘導し、ストレスに適応するための遺伝子の発現を誘導する。この一連の翻訳制御は、各種のストレスに対応する複数種のeIF2リン酸化酵素の活性化から端を発し、eIF2のリン酸化に集約されているため、統合的ストレス応答(integrated stress response:ISR)と呼ばれている。
- [5]翻訳開始因子、eIF2B、eIF2
- 「翻訳開始因子」は、細胞内でタンパク質の合成(翻訳)を行うリボソームが、合成を開始する際に協調的に働くタンパク質群。真核生物の翻訳開始因子は、真核生物型開始因子(eIF;eukaryotic Initiation Factor)と呼ばれる。その一つである「eIF2」は、三つのサブユニットからなるGタンパク質で、GTP(グアノシン三リン酸)が結合すると翻訳に参加できる。「eIF2B」は、eIF2をGDP(グアノシン二リン酸)結合型(不活性型)からGTP結合型(活性型)へと変換する作用を持つ。
- [6]リン酸化
- タンパク質を構成するアミノ酸のうち、セリン、スレオニン、チロシン残基の持つ水酸基(-OH)に、リン酸基が付加される反応をタンパク質のリン酸化と呼ぶ。リン酸基の付加は、しばしばタンパク質の構造変化を招き、細胞内シグナル伝達の制御などに重要な役割を果たす。
- [7]サブユニット
- タンパク質が集まってできた複合体の中の構成単位のこと。通常はポリペプチド鎖で連なった一つのタンパク質分子に相当する。
- [8]クライオ電子顕微鏡法
- 生体試料を液体エタンにより急速凍結し、ガラス状の氷に閉じ込め、透過型電子顕微鏡を用いて直接観察する手法。画像処理技術を駆使することで、リボソームなどの超分子複合体や、タンパク質複合体の三次元立体構造を得ることができる。
発表者・機関窓口
発表者
理化学研究所 生命機能科学研究センター 翻訳構造解析研究チーム
チームリーダー 伊藤拓宏(いとうたくひろ)
研究員 柏木一宏(かしわぎかずひろ)
生命機能科学研究センターに関する問い合わせ
理化学研究所 生命機能科学研究センター センター長室 報道担当
山岸敦(やまぎしあつし)
E-mail:ayamagishi“AT”riken.jp
機関窓口
理化学研究所 広報室 報道担当
E-mail:ex-press“AT”riken.jp
*今般の新型コロナウイルス感染症対策として、理化学研究所では在宅勤務を実施しておりますので、メールにてお問い合わせ願います。
AMED事業に関する連絡先
日本医療研究開発機構(AMED)創薬事業部 医薬品研究開発課
創薬等ライフサイエンス研究支援基盤事業(BINDS)
Tel:03-6870-2219 Fax:03-6870-2244
E-mail:20-ddlsg-16“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年11月21日
最終更新日 令和2年11月21日


