プレスリリース ごく少数の「マイナーイントロン」ががんを導くメカニズムを初めて解明―不要な遺伝情報を除去できずがんに至る―
プレスリリース
公益財団法人神戸医療産業都市推進機構
国立研究開発法人日本医療研究開発機構
神戸医療産業都市推進機構先端医療研究センター血液・腫瘍研究部の井上大地上席研究員らの研究グループは、米国メモリアルスロンケタリングがんセンターのOmar Abdel-Wahab博士、フレッドハッチンソンがん研究センターのRobert K. Bradley博士らとの共同研究により、ゲノム上にごく少数しか存在しない「マイナーイントロン」と呼ばれる配列が遺伝情報の伝達の際に適切に除去(スプライシング)できないことで発がんに至る新しいメカニズムを初めて解明しました。
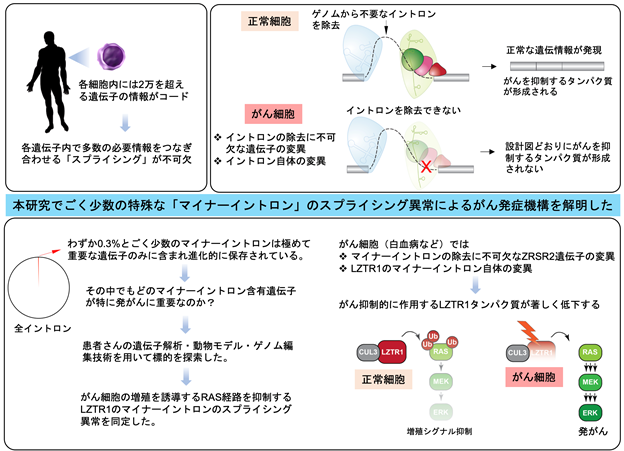
遺伝情報をコードするエキソンをつないでいるイントロン配列は、全ゲノム内に数十万個存在しており、スプライシングの過程で除去されます。また、全イントロンのわずか0.3%は「マイナーイントロン」として重要な遺伝子のみに含まれており、通常とは異なる機序でスプライシングされます。これらの特殊なイントロンは、機能的に重要な遺伝子にのみ含まれていることから、その制御異常は発がんなどに深く関わっていることが予想されていました。スプライシングの異常が発がんの直接的な原因となるという知見が相次いでいますが、少数ながら進化的に高度に保存されたマイナーイントロンの発がんにおける機能は全く解明されていませんでした。
本研究では、まず、マイナーイントロンのスプライシングを制御するZRSR2遺伝子の機能喪失型変異が血液がんで報告されていることに注目しました。ZRSR2変異を有する患者RNAデータの解析やZrsr2ノックアウトマウスの作成を介して、mRNAの段階でマイナーイントロンが適切に除去されずにmRNAごと分解され、標的遺伝子の機能喪失に至る現象をZRSR2による制御機構と合わせて分子レベルで捉えることに成功しました。さらに、ゲノム編集技術を応用したCRISPRスクリーニング法により、発がんに重要なスプライシング異常をきたす標的遺伝子の探索を行い、RAS関連分子を負に制御するLZTR1のスプライシング異常を同定しました。すなわち、ZRSR2変異はLZTR1の喪失を介して、造血細胞の形質転換やクローン拡大に寄与していることを示しました。さらに、様々ながんでLZTR1のマイナーイントロン上の変異が検出され、上記と同様のスプライシング異常を惹起することを明らかにし、マイナーイントロンを介したLZTR1mRNAの制御に基づいた新規発がん経路の存在を発見しました(図1)。
これらの研究でマイナーイントロンと発がんとの関わりを初めて明らかにしただけでなく、がん促進的に機能するイントロン変異の同定においても、新しい手法を提案することができました。LZTR1のスプライシング異常は血液がんにとどまらず、多くの固形がんにも幅広く認められる現象であることも本研究で明らかになりました。マイナーイントロンのスプライシング異常による発がん機構は近年とても注目されており、本研究が発展することで、スプライシング異常が引き起こす病気の理解や新しい治療標的の開発につながることが期待されます。
本研究成果は、2021年4月12日(米国東部時間)に国際科学誌『Nature Genetics』(オンライン版)に掲載されます。
研究の背景と概要
我々の細胞のDNA上には2万個以上の遺伝子がコードされていますが、各遺伝子の情報は主にエキソンと呼ばれる配列にコードされており、エキソンと隣のエキソンの間はイントロンと呼ばれる非コード領域によって分断されています。遺伝情報がメッセンジャーRNAに転写される過程でイントロンが取り除かれ、コード領域のエキソンのみが結合した核酸配列がタンパク質の設計図となります。このイントロンが除かれエキソン同士が結合する過程はスプライシングと呼ばれ、遺伝情報に基づいて正常なタンパク質を作り出す上で必須の機構と言えます。
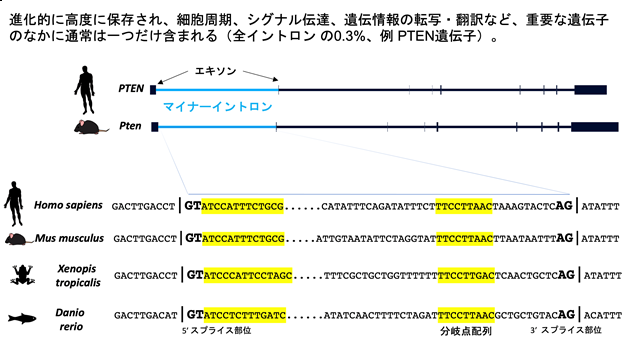
ゲノム上に数十万個存在するイントロンはそれらのスプライシング機構の視点から、99.7%を占めるU2タイプとわずか0.3%のU12タイプに分類されます。後者はごく少数のため「マイナーイントロン」(注1)と呼ばれていますが、進化的に強く保存され、細胞の生存に必須とされる重要な遺伝子にのみ含まれていることから(図2)、マイナーイントロンが様々な生理機構や発がんに関与していることが予想されていました。しかし、その詳細はほとんど解明されていませんでした。そこで、本研究ではマイナーイントロンのスプライシングに不可欠なZRSR2遺伝子の変異をもつ患者群やマウスモデルの解析、ならびにがんの発症や進展に不可欠な標的を新規スクリーニングにより見つけ出し、進化的に保存され機能が解明されていなかったマイナーイントロンのがんにおける役割を解き明かすことを目的としました。
まず、スプライシング異常(注2)をきたす原因としてスプライシングを担当するタンパクRNA複合体(スプライソソーム)自体の変異を血液がん患者のRNA検体を使用して探索しました。大多数を占めるU2タイプのイントロン除去に不可欠なタンパク質複合体の構成因子を中心に解析を行ったところ、SF3B1、SRSF2、U2AF1遺伝子の変異の他に、ごく少数のU12(マイナー)イントロンのスプライシングを担当しX染色体にコードされるZRSR2遺伝子の変異が男性患者のみに検出されることが分かりました。前者3つはホットスポットを有する機能獲得型変異であることが知られていますが、ZRSR2はコード領域全域にナンセンス及びフレームシフト変異を認め、前者とは異なり機能喪失型変異と予想されました。顕著な性差は、男性ではX染色体が1本しかないことと、女性においてX染色体の不活化からエスケープできるからと考えられます。
続いて、スプライソソームの変異によりどの様な転写産物が生じるのかについて、患者検体のRNAをスプライシング異常の観点から評価すると、ZRSR2遺伝子の変異をもつ造血幹前駆細胞ではマイナーイントロンが除去されずにmRNA内に転写後も残存してしまう現象(イントロンリテンション)が確認されました。このような転写産物は、早期終始コドンにより速やかに分解される機序(NMD)があることが知られています。このスプライシング変化がZRSR2による直接的なものか検討するために、eCLIP-seqと呼ばれる手法を用いて、ZRSR2のRNAワイドな結合を評価すると、やはりマイナーイントロン周囲への結合が確認されました。進化的に保存されたマイナーイントロンを有する遺伝子は700個程度しか存在せず、そのどれもが細胞の生存等において重要な役割を担っています。興味深いことに、このうち1/3程度は特にZRSR2変異により強くイントロンリテンションが誘導されていましたが、残り2/3は影響が軽微でした。そこで、両者のイントロンがどのように区別されているのかを配列パターンの観点から検討すると、ZRSR2の有無に影響を受けるマイナーイントロンはイントロン除去の際に必須となる分岐点とよばれる部位とイントロン/エキソン接合部である3'スプライス部位との距離に規定されることが明らかとなりました。すなわち、この距離が近いとZRSR2によるスプライシングの対象となることが分かり、マイナーイントロンとカテゴライズされる特殊なイントロンは少なくとも2つ以上にさらに分類できることが分かりました。
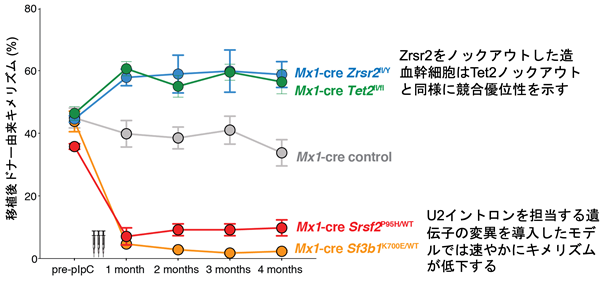
では、ZRSR2変異はスプライシング異常を介して血液がんを誘導するのでしょうか?この問いに答えるために、pIpCによりMx1プロモーター制御下にCreリコンビナーゼを発現するトランスジェニックマウスを利用して造血細胞特異的にZrsr2遺伝子をノックアウトできるマウスモデルを作成しました。Zrsr2を喪失した造血幹細胞は、既報のTet2をノックアウトした造血幹細胞と同様にコロニー形成能の亢進や、競合移植実験(注3)での優位性の獲得が認められました。一方で、U2イントロンのスプライシング異常をきたすことがすでに報告されているヒト変異を模倣したSf3b1やSrsf2の変異体ノックインモデルマウスでは、競合移植能が顕著に低下していました(図3)。すなわち、あらゆるスプライシング関連遺伝子変異の中でZRSR2変異は異なる効果を有しており、マイナーイントロンのスプライシング異常が発がんにおいて重要な役割を果たしていると考えられました。
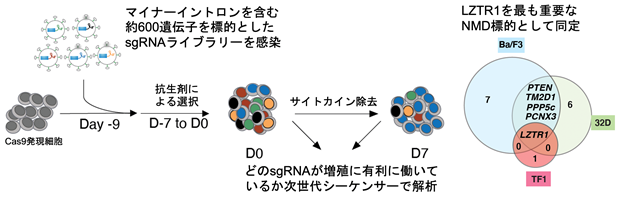
続いて、どのようなイントロンリテンションが発がんに重要なのかを特定する手法を開発しました。機能的CRISPRスクリーニング法として、まずNMD標的となる遺伝子群を予測してシングルガイドRNA(sgRNA)ライブラリーを作成し、様々な細胞株やマウスを用いて腫瘍化に寄与するNMD標的遺伝子の同定を試みました。これにより、Cas9とsgRNAを用いてDNA二本鎖を切断してゲノム配列の任意の場所を改変するゲノム編集を行うことで、特定の遺伝子をノックアウトすることが可能となります。このスクリーニングでは約600遺伝子を同時にノックアウトした細胞群を作成して、どの遺伝子のノックアウトが細胞の生存や増殖に有利に働いているかについて、統計学的手法を用いて検討しました。その結果、RASファミリー分子(注4)の分解に寄与するLZTR1遺伝子(注5)のNMDが最も重要な標的として見つけ出すことができました(図4)。LZTR1遺伝子の18番目のイントロンはマイナーイントロンに分類され、それ以外のイントロンは全てU2タイプのイントロンです。ZRSR2変異を持つ血液腫瘍ではLZTR1イントロン18のリテンションをきたして遺伝子ごと分解され、その結果RASファリミー分子の著しい発現上昇が認められました。CRISPR技術により、マイナーイントロンの分岐点周囲に変異を人為的に導入するだけで、造血幹細胞や細胞株が不死化することがわかり、同部位のスプライシングが発症に極めて重要であることを証明しました(図5)。
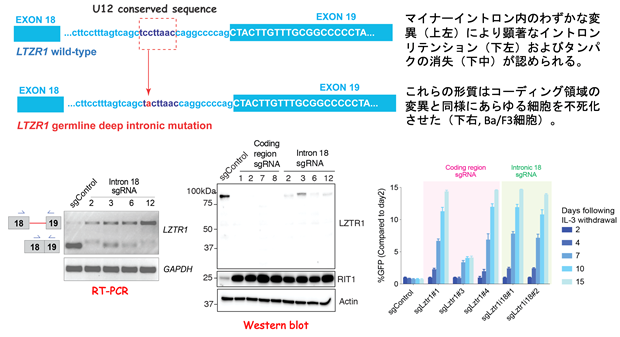
興味深いことに、ZRSR2変異を認めない急性白血病を含む悪性腫瘍で検出されるLZTR1遺伝子のイントロン変異が、ZRSR2変異細胞と同様の帰結を辿り、RAS/MAPK経路が活性化していることを合わせて発見しました。例えば、図5の白血病症例ではわずか1つのイントロン配列の違いでスプライシング異常を介してLZTR1が全く発現しないことが分かりました。マイナーイントロン内に認められるイントロン変異を人為的に導入した細胞はZRSR2変異細胞と同様にイントロンリテンションの増加とタンパク質レベルでの低下を認め、すみやかに不死化することから、LZTR1遺伝子に隠されたマイナーイントロンの重要性を支持する結果が得られました。LZTR1のコーディング領域の変異はRAS経路の活性化が原因となる悪性腫瘍や先天性疾患に比較的高頻度に認められていますが、マイナーイントロン内の変異も同様に疾患の原因となることを細胞株および生体モデルを用いて証明しました。最後に、このようなLZTR1遺伝子のイントロンリテンションは、ZRSR2変異を有する血液腫瘍にとどまらず、がん横断的に観察されることも20種類を超える様々ながん患者RNAのデータ解析で明らかとなり、血液がんにとどまらず固形腫瘍に至るまでこの経路の重要性が示唆される結果といえます。
研究の成果と意義・今後の展開
がん化についての研究は、これまでにDNA・染色体レベルでの「遺伝情報の異常に基づくタンパク質異常」という枠組みの中で発展してきました。しかし、がんゲノム研究で明らかにされた非翻訳領域内の塩基置換の多くは無意味なものとして見逃されてきました。そこで、本研究グループは染色体異常やコーディング領域の変異の枠を超えた発がん機構があると考え、RNAレベルでの発現制御メカニズムや、非コード領域の異常、イントロン変異に着眼して研究を重ねてきました。今回の研究で、マイナーイントロンというごく少数の「隠された秘宝」が、悪性腫瘍の制御に極めて重要であることを統合的な解析から明らかにすることができました(図5)。U2タイプのイントロンのスプライシングに異常をきたすSF3B1遺伝子変異とその下流標的に関する報告(Inoue et al. Nature 2019)と合わせて、スプライシング異常による発がん機構について新知見をヒト・マウス・分子レベルで証明することが可能になりました。本研究グループが、これらのスプライシング異常に着眼した理由のひとつは特異的な治療応用が可能である点でといえます。核酸医薬ASO(Anti-sense oligonucleotide)によるイントロン転写の阻害、CRISPR技術によるスプライシングエンハンサー配列の除去、スプライソソーム阻害剤を用いてこれらの異常が修正し、新たな治療戦略として実用化されることが期待されます。
また、本研究で利用したCRISPRスクリーニング技術は、スプライシング異常をきたすイントロン変異の探索にも応用でき、これまで大半が意味のない1塩基置換と考えられてきたものの中から、LZTR1のマイナーイントロン変異のように発がんに直接的に寄与するものを抽出する上で有用なツールとなることが期待されます。
現段階では、なぜイントロンリテンションががん横断的に認められるのかは明らかとなっていませんが、その未知の機構の探索や上記の治療応用の可能性について検討を進める予定です。またLZTR1の基質として数あるRAS関連タンパク質の中でどの経路が重要であるのか、タンパク質レベルでの解析を行なっていきます。さらに、本研究グループはSF3B1やZRSR2などあらゆるスプライシング関連遺伝子変異に共通した標的遺伝子の同定に成功しており、これらの造血における役割についてノックアウトマウス等を用いて検討し、新規メカニズムに基づいた治療開発を目指します。
特記事項
本研究は国立研究開発法人日本医療研究開発機構(AMED)の次世代がん医療創生研究事業における研究開発課題「マイナーイントロンのスプライシング異常による発癌機構と治療応用に関する研究」、JSPS科研費(JP20H00537, JP 20H03717)、武田科学振興財団、MSD生命科学財団、安田記念医学財団、かなえ医薬振興財団、ブリストル・マイヤーズスクイブ株式会社研究助成の支援によって行われました。
掲載論文
- 英文タイトル
- Minor intron retention drives clonal hematopoietic disorders and diverse cancer predisposition
- タイトル和訳
- マイナーイントロンリテンションは造血器腫瘍など多様ながんにおけるクローン拡大やがん発症を誘導する
- 著者名
- Daichi Inoue, Jacob T. Polaski, Justin Taylor, Pau Castel, Sisi Chen, Susumu Kobayashi, Simon J. Hogg, Yasutaka Hayashi, Jose Mario Bello Pineda, Ettaib El Marabti, Caroline Erickson, Katherine Knorr, Miki Fukumoto, Hiromi Yamazaki, Atsushi Tanaka, Chie Fukui, Sydney X. Lu, Benjamin H. Durham, Bo Liu, Eric Wang, Sanjoy Mehta, Daniel Zakheim, Ralph Garippa, Alex Penson, Guo-Liang Chew, Frank McCormick, Robert K. Bradley, Omar Abdel-Wahab
- 掲載誌
- Nature Genetics
- DOI
- 10.1038/s41588-021-00828-9
用語解説
- (注1)マイナーイントロン
- 進化の過程で長く保存されてきたイントロンであり特殊な配列を持ち、通常とは異なるメカニズムでスプライシングされる。全ゲノムの中でわずか700個程度しか存在せず、進化的にも重要な遺伝子の中に通常はひとつだけ含まれている。ZRSR2などマイナーイントロンのスプライシングに携わる遺伝子の変異が血液がんを中心に報告されている。
- (注2)スプライシング異常
- DNAの塩基配列に基づく遺伝情報から,不要な部分を取り除く編集作業をスプライシングという。エキソンにコードされた各遺伝情報は暗号としての意味をもたないイントロンによって中断されており、スプライシングによって不要箇所のイントロンが除去され成熟したメッセンジャーRNAとなる。この過程で異常が生じるとメッセンジャーRNAが分解されたり、正常とは異なるタンパク質が生成される。
- (注3)競合移植実験
- モデルマウス(ノックアウトマウスなど)の骨髄細胞を競合細胞(通常は野生型骨髄細胞)と一定割合で混合後、致死量放射線照射したレシピエントマウスに移植して、生体内での造血再構築能を評価する実験。キメリズムを用いて競合的優位性を経時的に追跡することが可能である。
- (注4)RAS
- 低分子GTP結合タンパク質の一種で、細胞増殖、転写、細胞死の抑制などに関わる。様々ながんでRASの活性型変異が高頻度に報告されており、下流シグナルと合わせてがん化において最も重要な経路の一つといえる。
- (注5)LZTR1
- RAS関連分子をユビキチン化により制御するCUL3のアダプタータンパクとして機能し、正常細胞ではRAS経路の抑制に寄与する。2018年以降、LZTR1の機能低下や変異による発がん機構が相次いで報告され近年注目を浴びているがん抑制遺伝子である。
本発表資料のお問い合わせ先
公益財団法人神戸医療産業都市推進機構
先端医療研究センター 血液・腫瘍研究部
上席研究員(グループリーダー) 井上 大地 (いのうえ だいち)
TEL:078-515-6228 FAX: 078-306-0898
E-mail:d-inoue“AT”fbri-kobe.org
本リリースの配信元
公益財団法人神戸医療産業都市推進機構
クラスター推進センター 都市運営・広報課
塚口・太田
TEL:078-306-2231
E-mail:kbic-pr“AT”fbri-kobe.org
AMED事業に関する問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部医薬品研究開発課
TEL:03-6870-2311
E-mail:cancer”AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年4月13日
最終更新日 令和3年4月13日


