プレスリリース 高脂肪食などによる肥満が薄毛・脱毛を促進するメカニズムの解明―幹細胞における炎症・再生シグナルの異常が毛包の萎縮を引き起こす―
プレスリリース
国立大学法人東京医科歯科大学
国立大学法人東京大学医科学研究所
株式会社アデランス
国立研究開発法人日本医療研究開発機構
ポイント
- 高脂肪食の過剰摂取や遺伝性の肥満がマウスの脱毛症の発症を促進することを示しました。
- 毛包幹細胞の中で酸化ストレス、脂肪滴、炎症性シグナルが段階的に発生し、幹細胞と毛を再生させるソニックヘッジホッグ(Shh)経路を抑制することを明らかにしました。
- 毛包幹細胞においてShh経路が抑制されると、毛包幹細胞が表皮または脂腺への分化によって失われ、これによって毛包のサイズが小さくなり毛が細くなることを明らかにしました。
- 早期からの予防的介入により毛包幹細胞を維持することによって脱毛症の進行を抑制できることが明らかになりました。
東京医科歯科大学・難治疾患研究所・幹細胞医学分野の西村栄美教授(東京大学医科学研究所・老化再生生物学分野 教授兼任)と森永浩伸プロジェクト助教らのチームは、ミシガン大学や東京理科大学などとの共同研究により、肥満を引き起こす要因が毛包幹細胞に働きかけ脱毛を促進する仕組みを突き止めました。この研究は、国際科学誌Nature(ネイチャー)に、2021年6月23日午後4時(英国夏時間)にオンライン版で発表されました。本研究は、国立研究開発法人日本医療研究開発機構(AMED)『老化メカニズムの解明・制御プロジェクト』やアデランス社による実用化研究支援などの支援のもと行われました。
研究の背景
わたくしたちの体を構成する多くの臓器は、加齢に伴いその機能や再生能力が低下し、様々な加齢関連疾患を発症するようになります。年齢とともに基礎代謝量が低下し中年期に太りやすくなることはよく知られていますが、肥満がいかに臓器の老化や加齢関連疾患の発症と関わるのか、どの細胞集団が主たる標的となっているのか、いかなるプロセスやメカニズムによるのかその全容は解明されていません。
加齢に伴う脱毛は典型的な老化形質として知られ、中年期から進行します。肥満が男性型脱毛症の危険因子となることは疫学調査によって示されていますが、肥満がより広く薄毛・脱毛に関わっているのかどうか、またその仕組みについては明らかにされていません。
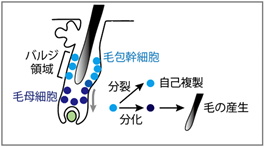
研究グループは、毛の再生の元となる毛包幹細胞※1に着目し、加齢による薄毛・脱毛が毛包幹細胞の枯渇によることをこれまでに明らかにしてきました(文献※2)。本来、毛包幹細胞は毛包のバルジ領域と言われる部位に局在し、自己複製によって幹細胞プールを維持しながら毛を生やす毛母細胞を供給しています(図1)。若年期においては、毛包幹細胞を周期的に活性化し、毛包の再生と退縮を反復することで毛が周期的に生え変わっていますが、年を取ると毛包幹細胞が自己複製せずに表皮細胞に分化し、幹細胞プールが維持されなくなり、毛を再生できなくなります※2。しかし、これはあくまで遺伝的にも環境的にも同一条件下で見られる毛包の老化に相当し、ヒトにおいては様々な生活習慣や遺伝要因が大きく影響し、脱毛の進行に個体差を生じることは明らかです。肥満の環境因子や遺伝因子が器官の機能低下を引き起こすメカニズムの解明は、脱毛症に限らず様々な加齢関連疾患の理解と制御へとつながると考えられます。
研究成果の概要
本研究では、生活習慣が毛の周期的再生に及ぼす影響や老化との関連を調べるために、老若両方のマウスに高脂肪食を与え、その違いを検証しました。加齢マウスにおいては、1ヶ月間だけ高脂肪食を摂取するだけでも毛が再生しにくくなり、若齢マウスにおいては、数ヶ月以上の高脂肪食に加え毛周期(ヘアサイクル)を繰り返すことによって毛が薄くなることが明らかになりました(図2)。次にその違いが発生する仕組みを明らかにするため、マイクロアレイやRNA-seq法などを用いた網羅的遺伝子発現解析※3ならびに毛包幹細胞の遺伝学的細胞系譜解析(運命追跡)※4を行いました。その結果、4日間という短期の高脂肪食でも毛包幹細胞において酸化ストレスや表皮分化に関わる遺伝子の発現が誘導されましたが、若い個体では毛包幹細胞のプールは維持され毛の再生への影響を認めませんでした。一方、3ヶ月以上にわたり高脂肪食を摂取したマウスにおいては、毛包幹細胞内に脂肪滴※5が蓄積し、成長期に毛包幹細胞が分裂する際に表皮または脂腺へと分化することで幹細胞の枯渇が進むことが明らかになりました(図3)。その結果、毛包の萎縮(ミニチュア化)※6を引き起こして、毛の再生を担う細胞が供給されなくなるために、脱毛症が進行し、毛が細くなったり毛が生えなくなるなどの脱毛症の諸症状が現れることが明らかになりました(図3、図4)。
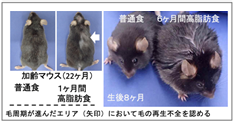
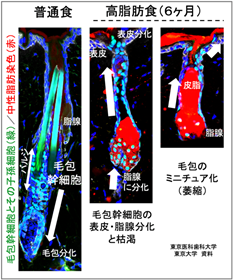
矢印は幹細胞の子孫細胞(緑色)の移動方向を示す。
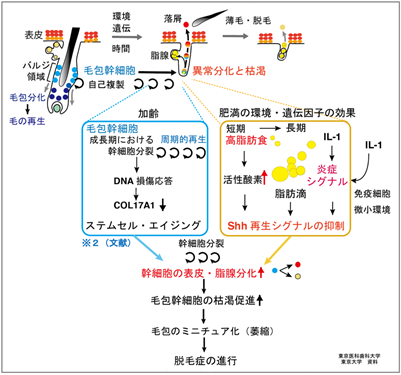
本来は、毛包が成長期に入って幹細胞が分裂する際にソニックヘッジホッグ経路※7(以下Shh経路)が強く活性化されますが、3ヶ月以上にわたり高脂肪食を摂取すると十分な活性化が起こらなくなることが明らかになりました(図4)。Shhシグナル伝達経路は、本来その活性化によって毛包幹細胞を増やし毛を再生し続けますが、遺伝要因により肥満したマウスにおいても同様にShh経路の活性化が十分に起こっていませんでした。実際、若齢マウスにおいて成長期毛包の毛包幹細胞においてShh経路を抑制すると、同様に幹細胞の異常分化や枯渇、毛包の萎縮による薄毛・脱毛が起きることがわかりました。さらにどのような仕組みでShh経路の活性化が起こらなくなるのか調べたところ、IL-1bやNF-KBに代表される炎症性サイトカインシグナルが幹細胞内に発生し、再生シグナルであるShh経路を強力に抑制していました。
最後に毛包幹細胞におけるShh経路の再活性化によって肥満による薄毛や脱毛が改善するかを調べるため、遺伝学的手法ならびに薬理学的手法を用いて検証したところ、高脂肪食の開始初期からShh経路を活性化し幹細胞を維持した場合にのみ、脱毛症の進行を抑制できることが確認できました。
研究成果の意義
老化メカニズムの解明とその制御は、超高齢化社会において喫緊の課題となっています。特に先進国で深刻な問題となっている肥満は、糖尿病や虚血性心疾患、認知症、がんなど、多くの加齢関連疾患の危険因子であり、『万病の元』となることが知られています。しかし、老化と肥満の関わりは十分に理解されていません。本研究では遺伝的に均一なマウスを用いて毛を生やす機能を担う小器官である毛包において、肥満の環境要因や遺伝学的要因が幹細胞内でのシグナルへと収束して再生シグナルを抑制し、これが幹細胞の枯渇と器官の機能低下に対して決定的に働くことを明らかにしました(図4の右上)。加齢や毛周期ごとの周期的再生による幹細胞老化(ステムセルエイジング)(文献※2)(図4の左上)とは異なる経路を介しながらも、いずれも幹細胞の枯渇を引き起こし(図4の下)、相乗的に脱毛症を進行させることが明らかになりました。またそのプロセスが潜在性に進行することから、予防の重要性は明らかです。今後、幹細胞を中心とした更なるメカニズムの解明によって、脱毛症をはじめとする様々な加齢関連疾患の予防や治療に対する新たな戦略へとつながることが期待されます。
用語解説と文献
- ※1
- 毛包とは、毛を産生する哺乳類の皮膚付属器官。毛包幹細胞は、毛包の再生を担う組織幹細胞で、バルジ領域(膨隆部)に存在し、普段は毛の周期的再生を担う領域の再生を担っている。
- ※2
- 文献
- Matsumura H, Mohri Y, et al. Hair follicle aging is driven by transepidermal elimination of stem cells via COL17A1 proteolysis. Science, 351(6273):575-589, 2016
- Matsumura H et al. Distinct types of stem cell divisions determine organ regeneration and aging in hair follicles. Nature Aging, 1: 190-204, 2021
- ※3
- 毛周期を制御することにより毛包の成長期や休止期など異なる毛時期における毛包幹細胞において発現する全遺伝子の発現解析(網羅的遺伝子発現解析)が可能である。
- ※4
- 遺伝学的細胞系譜解析:遺伝子組換えにより特定の細胞に蛍光蛋白の発現などの永続的な標識を行い、その細胞とその細胞から生み出される子孫細胞を全て追跡する手法。毛包幹細を特異的に標識することにより、毛包幹細胞の系譜が明らかとなり、短期または長期にわたる幹細胞の運命を生体内において追跡することが可能である。
- ※5
- 脂肪滴は、トリグリセリドやコレステロールなどの過剰な脂質を貯蔵するための液滴状の細胞小器官。脂肪細胞の脂肪滴の存在は古くから知られていたが、脂肪細胞以外の細胞にも存在しうる。
- ※6
- 毛包のミニチュア化(萎縮)は、男性型脱毛症の進行に伴う毛包の比例的な縮小現象として見出された。しかし、ヒトやマウスの加齢性脱毛や放射線による脱毛の進行過程においても段階的に認めるなど、毛包幹細胞のプールが減少した際に共通して見られる(※2文献)。
- ※7
- ソニックヘッジホッグ伝達経路は、細胞外シグナル因子のソニックヘッジホッグの下流にあるシグナル伝達経路で、形態形成や細胞増殖を制御する重要な経路として知られる。
論文情報
- 掲載誌
- Nature
- 著者
- Hironobu Morinaga, Yasuaki Mohri, Marina Grachtchouk, Kyosuke Asakawa, Hiroyuki Matsumura, Motohiko Oshima, Naoya Takayama, Tomoki Kato, Yuriko Nishimori, Yuriko Sorimachi, Keiyo Takubo, Takayoshi Suganami, Atsushi Iwama, Yoichiro Iwakura, Andrzej A. Dlugosz, Emi K. Nishimura
- 論文タイトル
- Obesity accelerates hair thinning by stem cell-centric converging mechanism
研究者プロフィール
森永 浩伸(モリナガ ヒロノブ)Hironobu Morinaga
東京医科歯科大学 難治疾患研究所 幹細胞医学分野 プロジェクト助教
研究領域
幹細胞生物学、老化生物学、など
西村 栄美(ニシムラ エミ)Emi K. Nishimura
東京医科歯科大学 難治疾患研究所 幹細胞医学分野 教授
東京大学医科学研究所 老化再生生物学分野 教授
研究領域
幹細胞生物学、老化・再生生物学、皮膚科学、実験病理学など
お問い合わせ先
報道に関すること
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm“AT”tmd.ac.jp
東京大学医科学研究所 国際学術連携室(広報)
〒108-8639 東京都港区白金台4-6-1
TEL:090-9832-9760
E-mail:koho“AT”ims.u-tokyo.ac.jp
アデランスへのお問い合わせ
株式会社アデランス
グループCSR広報室
TEL:03-3350-3268
E-mail:pr“AT”aderans.com
AMED事業に関するお問い合わせ
日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課
TEL:03-6870-2286 FAX:03-6870-2243
老化メカニズムの解明・制御プロジェクト
E-mail:aging“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年6月24日
最終更新日 令和3年6月24日


