プレスリリース 細胞シグナルを精密に制御する、スマートな人工細胞増殖因子の開発に成功―低副作用の再生医療の実現に貢献する分子技術―
プレスリリース
東京大学
理化学研究所
科学技術振興機構
日本医療研究開発機構
発表者
秋山 桃子(東京大学大学院工学系研究科化学生命工学専攻 博士課程2年)
植木 亮介(東京大学大学院工学系研究科化学生命工学専攻 助教)
柳川 正隆(理化学研究所開拓研究本部 研究員、JSTさきがけ研究員)
阿部 充宏(理化学研究所開拓研究本部 専任研究員)
廣島 通夫(理化学研究所開拓研究本部 研究員)
佐甲 靖志(理化学研究所開拓研究本部主任研究員)
山東 信介(東京大学大学院工学系研究科化学生命工学専攻 教授)
発表のポイント
- 組織の再生や保護、幹細胞の増殖や分化などに関与する「細胞増殖因子」の機能に着目し、その生理活性を任意の強度で再現する合成化合物の開発に成功しました。
- 上記の機能を持つ「スマートな人工細胞増殖因子」を、生体成分であるデオキシリボ核酸(DNA)に基づいて合理的に設計可能であることを初めて報告しました。
- 細胞増殖因子の異常な活性化は発がん・浮腫などの副作用を引き起こす可能性があるため、本技術は低副作用の再生医療の実現に貢献する新たな分子技術として期待されます。
発表概要
細胞増殖因子は、組織の再生や保護、幹細胞の増殖や分化に関与するタンパク質であり、再生医療等製品やES/iPS細胞の培養因子として広く応用されています。しかし、細胞増殖因子がもたらす細胞シグナル伝達(注1)は、異常な活性化により発がん・浮腫などの副作用を示す可能性があることが知られ、再生医療等製品としての応用を妨げる一因となっていました。
今回、東京大学大学院工学系研究科の 秋山 桃子博士課程大学院生、植木 亮介助教、山東 信介教授、理化学研究所開拓研究本部の柳川 正隆研究員、佐甲 靖志主任研究員らの共同研究グループは、増殖因子の生理活性を任意の強度で再現するスマートな人工細胞増殖因子の開発に成功しました。本分子は、生体物質であるデオキシリボ核酸(DNA)(注2)から構成されており、低コストで化学的に合成することが可能です。本技術は、合理的な制御が難しかった細胞増殖因子の機能を、望みのまま制御する新たな手法を提供するもので、将来的に低副作用の再生医療の実現に貢献する分子技術として期待されます。
本研究成果は 2021年7月29日付でワイリードイツ法人(Wiley-VCH)が出版する科学誌 「Angewandte Chemie International Edition」にオンライン版が掲載されました。
発表内容
細胞増殖因子は、組織の再生や保護、幹細胞の増殖や分化に関与するタンパク質であり、その生理作用から、再生医療等製品やES/iPS細胞の培養因子として広く応用されています。しかし、細胞増殖因子がもたらす細胞シグナル伝達は、異常な活性化により発がん・浮腫などの副作用を示す可能性があること、また、増殖・分化・運動性など多面的な細胞機能の制御に関与するために、予期しない副作用をもたらす可能性が指摘され、再生医療等製品としての応用を妨げる一因となっていました。そのため、シグナル伝達の強度制御が可能なスマートな人工細胞増殖因子の開発が求められてきました(図1)。
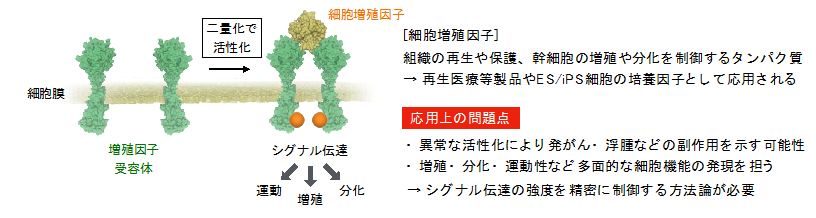
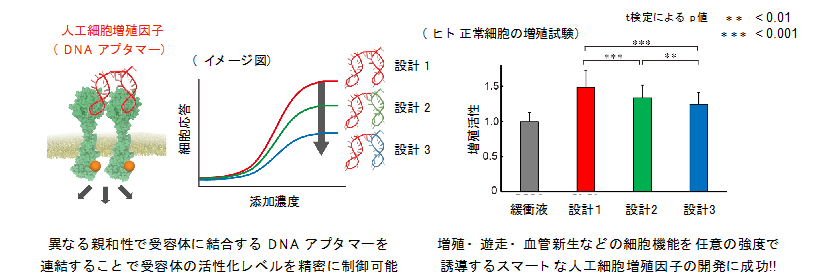
今回、東京大学大学院工学系研究科の秋山 桃子博士課程大学院生、植木 亮介助教、山東 信介教授、理化学研究所開拓研究本部の柳川 正隆研究員、佐甲 靖志主任研究員らの共同研究グループは、細胞増殖因子の生理活性を任意の強度で再現する、スマートな人工細胞増殖因子の開発に成功しました。細胞増殖因子は、細胞膜上の受容体と呼ばれる分子に結合し、二つの受容体を二量化(注3)させることで活性化させます。この受容体の活性化によって、細胞内へシグナルを伝達することで細胞の増殖・分化・運動性などの多様な機能制御を可能にしています。本研究グループは、受容体の二量化効率が変化することで、細胞シグナルの伝達効率が変化するというこれまでの知見に注目し、受容体の二量化効率を人為的に制御する人工細胞増殖因子のデザインを提案しました。この分子は、異なる親和性で受容体に結合する二分子のDNAアプタマー(注4)を連結して合成されており、連結するDNAアプタマーの親和性の組み合わせ方により、細胞シグナルの伝達効率を精密に制御できることが見出されました(図2左)。
本研究では、再生医療への応用の観点から重要な、細胞増殖や血管新生への影響を評価するため、ヒト臍帯静脈内皮細胞を用いた試験を実施しました。その結果、設計した三種類の人工細胞増殖因子は、これらの生理作用を異なるレベルで誘導することが確認され、合理的な制御が難しかった細胞増殖因子の機能を、望みのまま制御する新たな手法となり得ることが示されました(図2右)。今回開発した人工細胞増殖因子は、生体適合性が高く、低コストで化学的に合成可能なDNAから構成されており、新たな再生医療等製品の候補化合物や細胞培養添加因子などの幅広い応用が期待され、将来的には低副作用の再生医療の実現に貢献する分子技術として期待されます。また、未だに分子レベルでの全容が解明されていない、増殖因子受容体の活性化機構、細胞内へのシグナル伝達機構の解明においても、この人工細胞増殖因子は有用な化学ツールとなることが期待されます。
本研究は、上原記念生命科学財団、国立研究開発法人日本医療研究開発機構 創薬基盤推進研究事業、日本学術振興会科学研究費助成事業 若手研究、国立研究開発法人科学技術振興機構 研究成果最適展開支援プログラム(A-STEP) 産学共同(育成型)、野口遵財団の助成を受けて実施されました。
発表雑誌
- 雑誌名
- Angewandte Chemie International edition(オンライン版:2021年7月29日)
- 論文タイトル
- DNA-based Synthetic Growth Factor Surrogates with Fine-tuned Agonism
- 著者
- Momoko Akiyama‡, Ryosuke Ueki‡*, Masataka Yanagawa, Mitsuhiro Abe, Michio Hiroshima, Yasushi Sako, and Shinsuke Sando*(*責任著者、‡同程度の貢献)
- DOI番号
- 10.1002/anie.202105314 and 10.1002/ange.202105314
- アブストラクトURL
- https://onlinelibrary.wiley.com/doi/10.1002/anie.202105314
用語解説
- (注1)細胞シグナル伝達
- 細胞が外界の環境や刺激を感知し、正しく生理的応答を行うための情報伝達のしくみ。増殖因子が増殖因子受容体に感知された場合には、細胞内細胞シグナル伝達分子の化学反応や局在(細胞内での存在位置)の変化が次々と連鎖することで、細胞の応答が決定される。
- (注2)デオキシリボ核酸(DNA)
- 遺伝情報をコードする分子。通常は、細胞内の核と呼ばれる領域に存在し、螺旋型の二本鎖構造を形成している。現在では遺伝子工学・合成化学の発展によって、DNAの生物学的・化学的合成手法が確立されており、バイオマテリアルや情報保存担体としての応用も盛んに検討されている。
- (注3)受容体二量化
- 二分子の受容体が互いに近接すること。増殖因子受容体の多くは、増殖因子によって、二量体を形成、あるいは二量体構造の安定化が誘導されることによって、細胞内へのシグナル伝達を開始する。
- (注4)DNAアプタマー
- 標的分子に結合するDNA配列。生体内に存在するDNAとは異なり、一本鎖として存在して固有の折り畳み構造を取る。SELEX法(Systematic Evolution of Ligands by EXponential enrichment)と呼ばれる進化工学的手法によって、任意の標的を認識するDNAアプタマーを作製可能である。
お問い合わせ先
研究に関するお問い合わせ
東京大学大学院工学系研究科化学生命工学専攻
助教 植木 亮介 (ウエキ リョウスケ)
E-mail:r.ueki"AT"chembio.t.u-tokyo.ac.jp
TEL:03-5841-7327
東京大学大学院工学系研究科化学生命工学専攻
教授 山東 信介 (サンドウ シンスケ)
E-mail:ssando"AT"chembio.t.u-tokyo.ac.jp
報道に関するお問い合わせ
東京大学大学院工学系研究科 広報室
E-mail:kouhou"AT"pr.t.u-tokyo.ac.jp
理化学研究所 広報室 報道担当
E-mail:ex-press"AT"riken.jp
科学技術振興機構 広報課
E-mail:jstkoho"AT"jst.go.jp
TEL:03-5214-8404
JSTの事業に関するお問い合わせ
科学技術振興機構 産学連携展開部 研究支援グループ
星 潤一 (ホシ ジュンイチ)
E-mail:a-step"AT"jst.go.jp
TEL:03-5214-8994
AMEDの事業に関するお問い合わせ
日本医療研究開発機構 創薬事業部 医薬品研究開発課
E-mail:[email protected]
TEL:03-6870-2219
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年8月2日
最終更新日 令和3年8月2日


