たった1回の投薬で効く体内触媒戦法―細胞毒性ペプチドを金属触媒でがん細胞に貼り付ける―
プレスリリース
理化学研究所
東京工業大学
日本医療研究開発機構
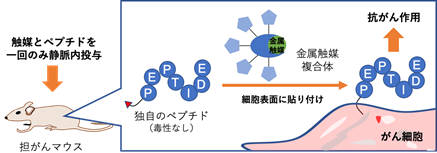
理化学研究所(理研)開拓研究本部田中生体機能合成化学研究室の田中克典主任研究員(理研科技ハブ産連本部糖鎖ターゲティング研究チーム副チームリーダー、東京工業大学物質理工学院応用化学系教授)、ペニー・アーマディ特別研究員(研究当時)、六車共平客員研究員(東京工業大学物質理工学院応用化学系日本学術振興会特別研究員)らの共同研究グループ※は、遷移金属触媒[1]を用いて、マウス体内のがん細胞表面に「細胞毒性ペプチド」を貼り付けることにより、腫瘍の成長を抑制し延命させることに成功しました。
本研究成果は、細胞毒性ペプチドと遷移金属触媒を静脈からたった1回注射投与するだけでがんを治療するという、前例のない効果的な生体内合成化学治療[2]であり、今後の創薬や医療に大きな影響を与えるものと期待できます。
がんの化学療法では、薬物の血中濃度を維持したり、がん細胞に対するダメージを蓄積させたりするために、抗がん剤を反復投与する必要があるのが課題でした。
今回、共同研究グループは、そのままでは無毒でありながら、細胞表面に貼り付けると細胞毒性を示す6アミノ酸残基からなるペプチド(Ac-Gly-Gly-Lys-Leu-Phe-Gly)を発見しました。このペプチドにベンジルフルオライド構造を導入したものと、遷移金属(ルテニウム)触媒複合体とをマウスに静注すると、体内で、反応性の高い中間体が生成されます。遷移金属触媒複合体は、がん組織に選択的に送達されるように設計されているため、ペプチドは効率よくがん細胞へ貼り付き(共有結合を形成)、抗がん作用が発揮されます。ペプチドと遷移金属触媒をマウスに1回投与するだけでがん細胞の増殖が抑制され、副作用も見られませんでした。
本研究は、科学雑誌『Chemical Science』のオンライン版(2021年9月2日付)に掲載されました。
※共同研究グループ
- 理化学研究所
- 開拓研究本部 田中生体機能合成化学研究室
- 主任研究員 田中 克典(たなか かつのり)(理研 科技ハブ産連本部糖鎖ターゲティング研究チーム副チームリーダー、東京工業大学 物質理工学院 応用化学系 教授)
- 特別研究員(研究当時) ペニー・アーマディ(Peni Ahmadi)
- 客員研究員 六車 共平(むぐるま きょうへい)(東京工業大学 物質理工学院 応用化学系 日本学術振興会特別研究員)
- 特別研究員 チャン・ツンチェ(Chang Tsung-che)
- 大学院生リサーチ・アソシエイト(研究当時) 坪倉 一輝(つぼくら かずき)
- 研究補助パートタイマーⅡ 江河 泰子(えがわ やすこ)
- 環境資源科学研究センター 生命分子解析ユニット
- ユニットリーダー 堂前 直(どうまえ なおし)
- 専任技師 鈴木 健裕(すずき たけひろ)
- 岩手医科大学 薬学部
- 准教授(研究当時) 田村 理(たむら さとる)(現 和歌山県立医科大学 薬学部 教授)
- 早稲田大学大学院 理工学術院
- 教授 中尾 洋一(なかお よういち)
研究支援
本研究は、日本医療研究開発機構(AMED)先端的バイオ創薬等基盤技術開発事業「糖鎖付加人工金属酵素による生体内合成化学治療(研究代表者:田中克典)」による支援を受けて行われました。
背景
がんの化学療法は、細胞に対して毒性を示す薬剤(抗がん剤)を投与し、がん組織にダメージを与えることで、がん(悪性腫瘍)の縮小を目指す治療法です。しかし、抗がん剤はがん細胞だけでなく正常細胞にも影響を及ぼすことから、さまざまな副作用が現れるという問題があります。正常細胞への影響を減らし、副作用を最小限に抑える手法として、抗がん剤を選択的にがん組織に送達する(薬物送達)、もしくは毒性を持たない化合物(プロドラッグ[3])をがん組織において毒性を示す化合物へと変換する方法などがあります。
これまでに田中克典主任研究員らは、体内遷移金属触媒反応を利用しプロドラッグの活性化法を開発してきました。通常、遷移金属触媒を生体に投与すると、グルタチオンなどの触媒毒[4]によってその機能は失われます。しかし、血清アルブミンタンパク質の疎水性ポケットの中へ遷移金属触媒を導入すると、遷移金属触媒が安定化され、生体内においても効率的に触媒反応が進行することを2019年に見いだしました注1)。この技術に基づいた体内遷移金属触媒反応により、2021年にはがん細胞に抗がん活性物質を貼り付ける(タギングする)ことで、副作用なく、がん細胞の増殖やがんの転移を抑制することに成功しました注2)。しかしこの治療では、効果が発揮されるまで複数回の薬物投与が必要という課題がありました。
注1)2019年7月2日プレスリリース理化学研究所「触媒的「現地合成」によるがん治療」
注2)2021年4月24日プレスリリース理化学研究所「世界初のマウス体内におけるタギング治療」
研究手法と成果
がん細胞に治療薬を貼り付けて治療する戦略では、治療薬の選択が重要です。共同研究グループはまず、遷移金属触媒を用いたがん細胞表面への貼り付け反応によって抗がん活性を示す化合物を探索しました。その結果、そのままでは無毒性(測定範囲内)ですが細胞表面に貼り付けると毒性を示す「細胞毒性ペプチド」を発見しました。この性質には、貼り付けることで、細胞表面のペプチド濃度が高まることが影響していると考えられます。
このとき用いた遷移金属触媒は、がんに集積する性質を持つRGDペプチド[5]で修飾したアルブミンタンパク質と複合体を形成します。そのため、生体に投与するとがん組織へ選択的に送達され、細胞毒性ペプチドを貼り付けることができます。
次に、細胞表面への貼り付け効率の良い反応を利用すれば治療効果を高められると考え、ルテニウム(Ru)触媒を用いた新しい反応を開発しました(図1)。この反応では、細胞毒性ペプチドに導入したベンジルフルオライド構造とルテニウム触媒によって反応性の高い中間体が生成され、がん細胞表面にペプチドを貼り付けることができます。これまで用いてきた金(Au)触媒による反応と比較しても、約20倍も効率的に進行します。
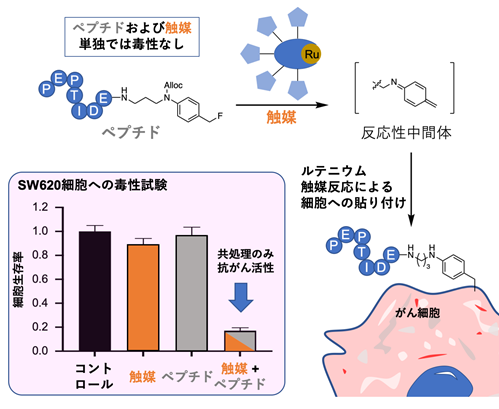
ペプチドとルテニウム触媒によるがん細胞に対する毒性を、SW620細胞(ヒト結腸がん細胞)を用いて評価したところ、ペプチド(使用した濃度:600μmol/L)や触媒(使用した濃度:20μmol/L)をそれぞれ単独で作用させた場合は細胞毒性を示さないのに対して、ペプチドと触媒の両方を作用させると毒性を示すことが分かりました(図1)。
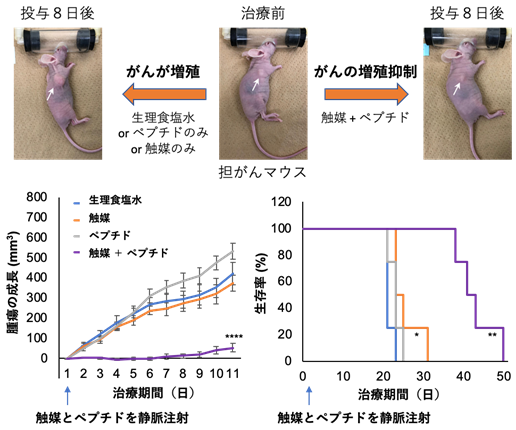
最後に、マウス個体における体内金属触媒反応による細胞毒性ペプチドの治療効果を評価しました。SW620細胞を移植した担がんマウス[6]を4群に分け、各マウスに①生理食塩水、②触媒のみ、③ペプチドのみ、④触媒とペプチドの両方をそれぞれ静脈内に1回注射投与し、腫瘍の成長を比較しました。その結果、①~③のマウス群では腫瘍の成長が抑制されず、25日前後で死亡したのに対し、④のマウス群では、腫瘍の成長が抑えられ、生存期間が2倍近く延長することが分かりました(図2)。また、副作用は見られませんでした。
今後の期待
本研究では、独自に見いだした細胞毒性ペプチドを体内金属触媒反応によりマウスにおいて、がん細胞に貼り付けることで、副作用なくがんを治療することに成功しました。これまでの生体内合成化学治療では、投与回数を減らすことができませんでしたが、ルテニウム触媒により、静脈からたった1回の投与で腫瘍の成長を抑えるという、これまでにない効果的な生体内合成化学治療が実現しました。
本成果により、これまでの研究室レベルの小さなスケールの研究からより現実的ながん治療へと発展することが可能になりました。今後、生体内合成化学治療の概念ががん治療における有用な治療基盤の一つとして発展するものと期待できます。
論文情報
- タイトル
- In vivo metal-catalyzed Selective Cell Tagging (SeCT) therapy by a proapoptotic peptide
- 著者名
- Peni Ahmadi, Kyohei Muguruma, Tsung-Che Chang, Satoru Tamura, Kazuki Tsubokura, Yasuko Egawa, Takehiro Suzuki, Naoshi Dohmae, Yoichi Nakao, Katsunori Tanaka
- 雑誌
- Chemical Science
- DOI
- 10.1039/d1sc01784e
補足説明
- [1]遷移金属触媒
- 周期表の第3族から第11族までに属する遷移金属元素の触媒。これらの元素は特定の官能基に対して強い親和性を示すため、さまざまな有機化学反応を触媒することが知られている。
- [2]生体内合成化学治療
- 通常はフラスコの中で行われる複雑な有機合成化学反応を、生体内(疾患部位)で行い、治療薬を体内で直接合成することで疾患を治療する手法。
- [3]プロドラッグ
- 生体内の薬剤標的部位での化学反応によって、薬効を示す分子に変換されるようにデザインされた薬剤。標的部位選択的に活性を示すことから、副作用の軽減が期待できる。標的部位での化学反応には、生体内の酵素による触媒反応や生体内の低分子との反応が主に用いられる。
- [4]触媒毒
- 触媒の作用を減退または消失させる物質。チオール基を含むグルタチオンが代表的な生体内の触媒毒である。
- [5]RGDペプチド
- アルギニン(R)、グリシン(G)、アスパラギン酸(D)から成るペプチド配列であり、多くの細胞接着性タンパク質中に見られる。がんの新生血管で発現が亢進しているインテグリンanb3に結合するため、RGDペプチドで修飾した分子はがん組織に選択的に送達できる。
- [6]担がんマウス
- がん細胞を免疫不全マウス(免疫に欠陥があるマウス)へ移植した実験モデル。
発表者・機関窓口
発表者
理化学研究所 開拓研究本部 田中生体機能合成化学研究室
主任研究員 田中 克典(たなか かつのり)
(理研 科技ハブ産連本部 糖鎖ターゲティング研究チーム 副チームリーダー、東京工業大学 物質理工学院 応用化学系 教授)
特別研究員(研究当時) ペニー・アーマディ(Peni Ahmadi)
客員研究員 六車 共平(むぐるま きょうへい)
(東京工業大学 物質理工学院 応用化学系 日本学術振興会特別研究員)
機関窓口
理化学研究所 広報室 報道担当
E-mail:ex-press“AT”riken.jp
*今般の新型コロナウイルス感染症対策として、理化学研究所では在宅勤務を実施しておりますので、メールにてお問い合わせ願います。
東京工業大学 総務部 広報課
E-mail:media“AT”jim.titech.ac.jp
日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課 先端的バイオ創薬等基盤技術開発事業担当
E-mail:sentan-bio“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年9月3日
最終更新日 令和3年9月3日


