プレスリリース がん細胞からiPS細胞が樹立できない分子メカニズムを解明―新しいがん分子標的薬の開発に道―
プレスリリース
東京大学
日本医療研究開発機構
発表者
伊藤 謙治(ペンシルベニア大学 Postdoctoral Fellow、研究当時:東京大学医科学研究所附属システム疾患モデル研究センター 先進病態モデル研究分野 特任研究員)
長田 巧平(東京大学医科学研究所附属システム疾患モデル研究センター 先進病態モデル研究分野 客員研究員/富山大学 第三内科 大学院生)
太田 翔(東京大学医科学研究所附属システム疾患モデル研究センター 先進病態モデル研究分野 助教)
山田 泰広(東京大学医科学研究所附属システム疾患モデル研究センター 先進病態モデル研究分野 教授)
発表のポイント
- マウス明細胞肉腫(Clear Cell Sarcoma 以下CCS)(注1)をモデルとして、がん細胞の増殖・生存に関わる細胞内シグナル経路(注2)の活性化が、がん細胞のiPS細胞化を阻害していることを明らかにした。
- がん細胞のiPS細胞化抵抗性に着目することで、がんの治療標的となる細胞内シグナル経路および分子標的薬を同定する薬剤スクリーニング方法(注3)を開発した。
- 開発したスクリーニング方法を利用して、CCSではmTOR経路(注4)が活性化しており、mTOR阻害剤がCCSの増殖を抑制することを見出した。iPS細胞技術を応用した独創的なスクリーニング方法は様々ながんの新規治療戦略の開発に貢献できる可能性がある。
発表概要
がん細胞からiPS細胞の樹立が困難であることが知られていますが、その原因は分かっていませんでした。山田泰広教授(東京大学医科学研究所附属システム疾患モデル研究センター 先進病態モデル研究分野)らの研究グループは、希少難治性がんである明細胞肉腫のマウスモデルを利用して、がん細胞で活性化している細胞内シグナル経路が、がん細胞のiPS細胞化を阻害していることを明らかにしました。 また、その性質を応用することで、それぞれのがんに対応した分子標的薬を同定するスクリーニング方法を開発しました。このスクリーニング方法を利用して、mTOR経路がCCSの治療標的となり、mTOR阻害剤が分子標的薬となりうることを示しました。加えて、p38MAPキナーゼ(注5) 阻害剤がmTOR阻害剤によるCCS増殖抑制効果を増強させることを見出しました。
本研究成果は、がん細胞からiPS細胞が樹立困難である分子メカニズムを明らかにしただけでなく、その知見をもとに開発した薬剤スクリーニング方法が、がん細胞の治療標的を同定する方法として有効であることを示しました。いまだに多くのがん種で効果的な分子標的薬が同定されていません。 本研究で開発したiPS細胞技術を応用したスクリーニング方法は、がんにおける分子標的薬の同定や新規治療戦略の開発に貢献できる可能性があります。 本研究成果は2022年4月27日(日本時間)、米国科学雑誌「Cell Reports」に公表されました。
発表内容
研究背景
様々な体細胞からiPS細胞樹立の成功が報告されてきましたが、がん細胞からiPS細胞を作製した研究成果はほとんどありませんでした。その原因として、がん細胞からiPS細胞の樹立が困難である(がん細胞がiPS細胞化に抵抗性を持つ)ことが挙げられます。しかし、がん細胞のiPS細胞化抵抗性の分子メカニズムについては分かっていませんでした。また、がん細胞は体細胞に遺伝子変異(DNAの配列異常)が起こることで細胞内シグナル経路が活性化した結果生じると考えられています。がん細胞で活性化した細胞内シグナル経路を標的にした治療法(分子標的療法)は、がん細胞を選択的に殺すことが出来ることから、効果的ながん治療法の一つであると考えられています。 しかしながら、多くのがん種において分子標的薬は同定されていません。そのため、それぞれのがんで治療標的となるシグナル経路を同定する方法の開発が望まれていました。本研究では、がん細胞が持つiPS細胞化抵抗性に関わる分子メカニズムの解明を目指しました。さらに得られた知見をもとにそれぞれのがんに対応した分子標的薬を同定するスクリーニング方法の開発を目指しました。
研究結果
1.がん細胞からiPS細胞を作製出来ない分子メカニズムの一端を解明
CCSの増殖・生存にはEWS/ATF1融合遺伝子の働きが必須であることが明らかになっています。EWS/ATF1融合遺伝子からつくられるEWS/ATF1融合タンパク質がDNA上に結合して、様々な遺伝子を働かせ、CCSが発生します。研究グループは、EWS/ATF1融合遺伝子の働きを調節可能なCCSマウスモデルからCCS細胞株を樹立していました(Yamada et al., JCI 2013, Komura et al.,Nature Commun. 2019)。
このCCS細胞にiPS細胞を誘導する細胞初期化因子(初期化因子)を働かせてiPS細胞の樹立を試みました。EWS/ATF1融合遺伝子が働いている条件下ではiPS細胞の樹立効率が極めて低い一方で、EWS/ATF1融合遺子の働きを止めた条件ではiPS細胞を樹立できることが分かりました(図1)。
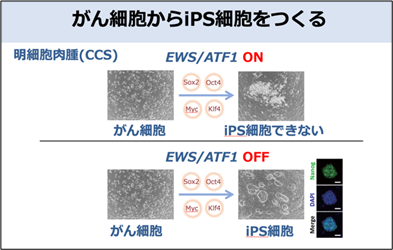
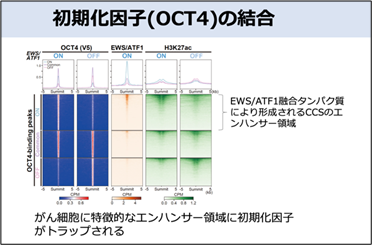
そこで、ChIP-seq(注6)という手法で、DNA上での初期化因子の結合パターンの変化を調べました。その結果、EWS/ATF1融合遺伝子が働いている(iPS細胞が樹立できない)条件下では初期化因子がEWS/ATF1融合タンパク質により形成されるCCSのエンハンサー(注7)領域に結合することが明らかとなりました(図2)。初期化因子ががん細胞に特徴的なエンハンサー領域にトラップされてしまうことで、iPS細胞が適切に誘導できないことが分かりました。
一方で、がん化に重要な遺伝子機能を抑制すれば、がん細胞に特徴的なエンハンサー領域が消失し、初期化因子の働きが回復することで、iPS細胞化が促進されることが明らかとなりました。
2.がん細胞のiPS細胞化抵抗性を利用することで、個々のがんに対応した分子標的薬を同定する薬剤スクリーニング方法を開発
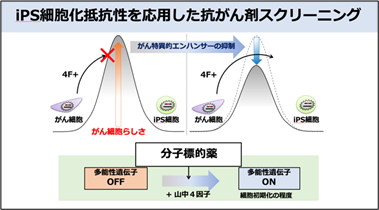
CCSで得られた知見をもとに、他のがん種でもがん細胞で活性化しているシグナル経路を抑制すればiPS細胞化が促進されるかを検討しました。がん治療に有効な分子標的薬が同定されているヒトがん細胞株を用いて、iPS細胞の作製を試みました。その結果、それぞれのがんに対応した分子標的薬を作用させると、NANOGをはじめとするiPS細胞化関連遺伝子の発現が亢進し、iPS細胞化が促進されることを明らかにしました。iPS細胞化の程度を評価することで、がんに対する分子標的薬を同定できる可能性が示唆されました。
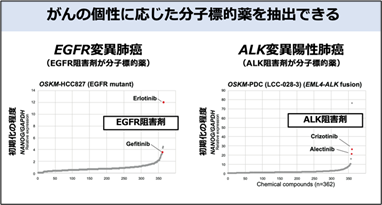
これらの知見をもとに、がんの分子標的薬を同定するスクリーニング系を開発しました(図3)。実際にこのスクリーニング系では、有効な分子標的薬が同定されているがん細胞株において多くの薬剤の中から該当する分子標的薬が抽出できることを確認しました(図4)。
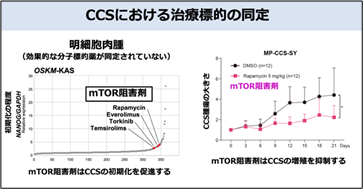
3.スクリーニングを利用して、CCSにおけるがん細胞の増殖・生存に重要なシグナル経路を同定し、治療候補薬剤を見出した
CCSの増殖・生存にはEWS/ATF1融合遺伝子の働きが必須であることがわかっていますが、EWS/ATF1融合遺伝子の働きによってどのような細胞内シグナル経路が活性化しているかは不明であり、有効な分子標的薬も同定されていませんでした。そのため、ヒトCCSの細胞株を用いてiPS細胞化抵抗性を指標としたスクリーニングを行いました。その結果、iPS細胞化を促進する薬剤としてmTOR経路の阻害剤が抽出されました。実際に、EWS/ATF1融合遺伝子によりmTOR経路が活性化されることや、mTOR阻害剤が試験管内、生体内でCCS細胞の増殖を強く抑制することが分かりました(図5)。
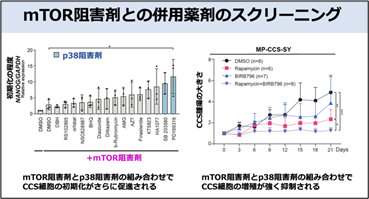
がんの治療には複数の分子標的薬の併用療法が有効であることが知られています。CCSに対する効果的な併用療法を開発するために、mTOR阻害剤との併用でiPS細胞化が促進される薬剤を探索しました。その結果、mTORの阻害剤とp38MAPキナーゼの阻害剤の併用でiPS細胞化が促進されることを見出しました。また、mTOR阻害剤単剤投与に比べ、mTOR阻害剤とp38阻害剤の併用でCCSの細胞増殖がより強く抑制されることを確認しました。このことから、本研究で開発した薬剤スクリーニング方法は、併用で効果のある分子標的薬の組み合わせを同定する方法としても有効であることが示されました(図6)。
まとめと展望
本研究では、がん細胞からiPS細胞の樹立ができない分子メカニズムを明らかにするとともに、その知見を応用してがん細胞で活性化している細胞内シグナル経路および分子標的薬を同定するスクリーニング方法を開発しました。効果的な分子標的薬が同定されていない難治性がんであるCCSに対して本スクリーニング方法を適用することで、CCSではmTOR経路が活性化しており、mTOR阻害剤がCCSの分子標的薬となりうることを見出しました。さらにp38MAPキナーゼ阻害剤がmTOR阻害剤との併用でCCSの増殖を強く抑制することを同定しました。このことは、本スクリーニング方法が、がん細胞で活性化している細胞内シグナル経路を同定する方法として有効なだけでなく、治療候補となる分子標的薬の同定、さらには、効果的な併用薬剤を同定する方法としても応用可能であることを意味しています。
未だ多くのがんで有効な分子標的薬が同定されていません。特にCCSのような希少がんでは研究開発が十分に進んでいません。今後このスクリーニング方法を応用することで、様々ながんの新規治療戦略の開発に貢献出来ることが期待されます。
論文情報
- 雑誌名
- Cell Reports(2022年4月26日 オンライン版 米国東部夏時間)
- 論文タイトル
- The oncogene-dependent resistance to reprogramming unveils cancer therapeutic targets
- 著者
- Kenji Ito, Kohei Nagata, Sho Ohta, Yutaka Matsuda, Tomoyo Ukai, Ichiro Yasuda, Akira Ota, Ryota Kobayashi, Mio Kabata, Nao Sankoda, Tatsuya Maeda, Knut Woltjen, Liying Yang, Reo Maruyama, Ryohei Katayama, Takuya Yamamoto, Yasuhiro Yamada
- DOI
- 10.1016/j.celrep.2022.110721
- URL
- https://doi.org/10.1016/j.celrep.2022.110721
研究支援
本研究は、日本医療研究開発機構(AMED)次世代がん医療創生研究事業(P-CREATE)の支援を受けて実施されました。
用語解説
- (注1)明細胞肉腫(Clear Cell Sarcoma : CCS)
- 皮下組織や筋肉などの軟部組織から発生する悪性腫瘍を軟部肉腫といい、その中でも皮膚や四肢(特に下肢)などの軟部組織にできる希少がん。青年期の若者に発症する。EWS遺伝子とATF1遺伝子が融合した遺伝子(EWS/ATF1融合遺伝子)が原因として知られている。有効な分子標的薬が同定されていない難治性がん。
- (注2)がん細胞の増殖・生存に関わる細胞内シグナル経路
- 遺伝子変異により活性化した細胞内の様々なシグナル経路のうち、がん細胞の増殖・生存に重要なシグナル経路はがんの治療標的となる。この経路は個々のがんごとに異なる。例えば肺がんではEGFR経路、EML4-ALK経路、MAPK経路などが知られ、この経路を阻害する分子標的薬はそれぞれのがんに対して効果的な治療薬となる。
- (注3)薬剤スクリーニング方法
- 多数の化合物の中から有効な化合物を見つけるための方法。
- (注4)mTOR経路
- 哺乳類などの動物での細胞内シグナル経路の一つ。免疫抑制剤ラパマイシンの標的分子として発見された。この経路が活性化するとタンパク質の合成を増加させたり、分解を抑制したり、細胞分裂などの調節に中心的な役割を果たすと考えられている。
- (注5)p38MAPキナーゼ
- 細胞内シグナル伝達に関与するタンパク質の一種。サイトカインおよびストレスに対する細胞応答を制御するシグナル伝達カスケードに関与する。
- (注6)ChIP-seq
- クロマチン免疫沈降法 (chromatin immunoprecipitation: ChIP) と次世代シークエンサーを組み合わせた解析技術。様々なDNA結合タンパク質のゲノム上での結合部位を網羅的に解析することができる。
- (注7)エンハンサー
- 遺伝子の転写調節部位であるプロモーターの活性を高めるDNA領域。エンハンサーの活性が、個々の細胞で異なる“細胞らしさ”を形成・維持している。
お問い合わせ先
本研究に関するお問い合わせ
東京大学 医科学研究所 附属システム疾患モデル研究センター 先進病態モデル研究分野
教授 山田 泰広(やまだ やすひろ)
電話:03-5449-5301
E-mail:yasu”AT"ims.u-tokyo.ac.jp
報道に関するお問い合わせ
東京大学医科学研究所 国際学術連携室(広報)担当:清水
E-mail:koho"AT"ims.u-tokyo.ac.jp
AMED 事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構 (AMED)
創薬事業部 医薬品研究開発課
次世代がん医療創生研究事業(P-CREATE)
電話:03-6870-2219
E-mail:jisedaigan”AT"amed.go.jp
※E-mailは上記アドレス”AT"の部分を@に変えてください
関連リンク
掲載日 令和4年4月27日
最終更新日 令和4年4月27日


