イントロン領域の複合ヘテロ接合性変異による「常染色体劣性STAT1完全欠損症」を、世界で初めて発見―診断率が向上し、早期診断治療に貢献できる可能性を示唆―
成果情報
広島大学
日本医療研究開発機構
本研究成果のポイント
- 従来のゲノム解析に加えて、網羅的遺伝子発現解析を行うことで、未診断患者の診断率の向上に寄与できる可能性を示しました。
- イントロン領域(注1)の複合ヘテロ接合性変異(注2)による、常染色体劣性STAT1完全欠損症(AR-STAT1完全欠損症)の、世界初の症例を同定しました。
- ターゲットRNAシークエンス(注3)を利用することで、患者におけるSTAT1遺伝子の発現低下の検出に成功し、全エクソーム解析(注4)で同定困難であったイントロン領域の変異を発見しました。
概要
STAT1は、インターフェロン-α/β、-γ(IFN-α/β、-γ)のシグナル伝達を介在し、宿主の感染防御を担う分子です。常染色体劣性STAT1完全欠損症(AR-STAT1完全欠損症)は、遺伝的要因でSTAT1の機能が欠損した極めて稀な疾患です。本症は、現在までに世界で5家系7症例しか報告されておらず、日本国内での報告はありません。生命を脅かす重症感染症のため自然予後は不良ですが、造血幹細胞移植により根治が見込めるため、早期診断が重要となる疾患です。
この度、国立研究開発法人日本医療研究開発機構(AMED)難治性疾患実用化研究事業のサポートを受け、岡田賢(広島大学大学院医系科学研究科小児科学教授)、小林正夫(同名誉教授)、坂田園子(同大学院生)らの研究グループは、東京医科歯科大学、小原收(かずさDNA研究所)及び、St. Giles Laboratory of Human Genetics of Infectious Diseases(ロックフェラー大学)との共同研究により、イントロン領域の複合ヘテロ接合性変異によるAR-STAT1完全欠損症を、世界に先駆けて同定することに成功しました。さらに本研究を介して、遺伝性疾患の診断におけるターゲットRNAシークエンス(注3)を用いた遺伝子発現解析の有用性を提唱しました。
本研究成果は、2020年6月30日に「International Immunology」で公開されました。
背景
原発性免疫不全症候群(PID)は、現在までに400種類近くの疾患が知られ、いずれも稀な疾患であるため、診断に苦慮することが少なくありません。近年多くの原因遺伝子が解明され、迅速で正確な診断に遺伝子検査が重要な役割を果たしています。特に、網羅的な遺伝子解析を実現した『全エクソーム解析(WES)(注4)』の導入により、今まで未診断であったPID患者の約1/3において、遺伝子解析による診断が可能となりました。一方で、残りの約2/3のPID患者はWESを実施しても遺伝子診断に至らず、これらの未診断患者における診断法の確立が課題とされてきました。
今回の研究対象であるSTAT1遺伝子は、PID発症に関与する遺伝子の一つで、インターフェロン-α/β、-γ(IFN-α/β、-γ)のシグナル伝達を行い、宿主の感染防御を担います。IFN-α/βはウイルスに対する生体防御に必須であり、IFN-γはマイコバクテリア(注5)などの細胞内に寄生する細菌に対する感染防御に必要です。STAT1は、IFN-α/β、-γの刺激によりリン酸化を受けて活性化し、抗ウイルス活性、抗マイコバクテリア活性を持つ遺伝子群の転写を誘導します。
常染色体劣性STAT1完全欠損症(AR-STAT1完全欠損症)では、STAT1遺伝子の機能が完全に失われ、IFNα/β、-γの経路が全て障害されます。そのため患者は、ウイルス、マイコバクテリアによる重篤な感染症を繰り返し、致死的な経過をたどります。本症は極めて稀で、これまでに世界で5家系7症例しか報告されておらず、国内での報告はありませんでした。非常に予後不良の疾患ではありますが、造血幹細胞移植により根治が見込めるため、早期診断を行い適切な治療介入を行うことが重要となります。
研究成果の内容
BCG接種後に播種性BCG感染症を発症した症例を経験し、原因検索のためWESを行いました。その結果、STAT1遺伝子のヘテロ接合性変異(c.128+2 T>G)が同定されました。無症状の母親も同一の変異を有していました。次に、研究グループは、ターゲットRNAシークエンス(注3)による遺伝子発現解析を実施しました。その結果、患者ではSTAT1遺伝子の発現が著明に低下していることを発見しました(図1)。得られた結果に基づき、WESデータを再解析したところ、STAT1遺伝子ヘテロ接合性変異(c.542-8 A>G)を同定することができました。この変異は、STAT1遺伝子のイントロン領域に存在していたことから、最初の解析で見逃されていたことが判明しました。患者の父親でも同一の変異が同定され、患者はSTAT1遺伝子のイントロン領域に、父由来(c.542-8 A>G)と母由来(c.128+2 T>G)の2つの変異(複合へテロ接合性変異)を有することが判明しました。
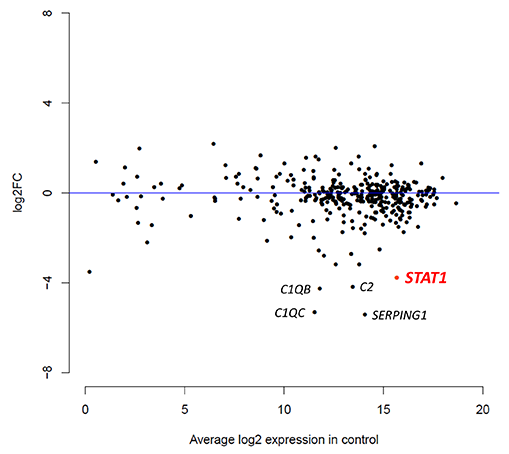
各プロットは、PID関連遺伝子(426遺伝子)の発現状況を表す。縦軸は、患者において該当遺伝子の発現がコントロールと比較してどれだけ変化しているかを、横軸はコントロールにおける該当遺伝子の発現量を示す。下方に位置する遺伝子は、コントロールと比較して患者で発現が低い遺伝子であり、本症患者でSTAT1遺伝子の発現低下が検出されている。患者で補体の異常は認めておらず、C1QB、C1QC、C2の発現低下に病的意義は無いと判断した。患者はSERPING1異常症と全く異なる表現型を呈したため、SERPING1の発現低下も病態に関連しないと判断した。
本症例で同定された2つのイントロン変異は過去に報告がない新しい変異でしたので、それらの病的意義を確認するために、STAT1の機能に及ぼす影響を検証しました。その結果、これら2つのイントロン変異が、STAT1のタンパク発現に影響を及ぼすことが明らかになりました。実際、患者の血液細胞では、STAT1タンパクが欠損していました。それにより患者の血液細胞は、IFN-γおよびIFN-α刺激に対する反応が著しく障害されていました(図2)。以上の結果から、同定された2つのイントロン変異は有害変異と判断し、AR-STAT1完全欠損症と診断しました。患者は経過中に、重症ウイルス感染症や播種性のマイコバクテリア感染症を反復しており、臨床的にも同診断と合致すると判断しました。
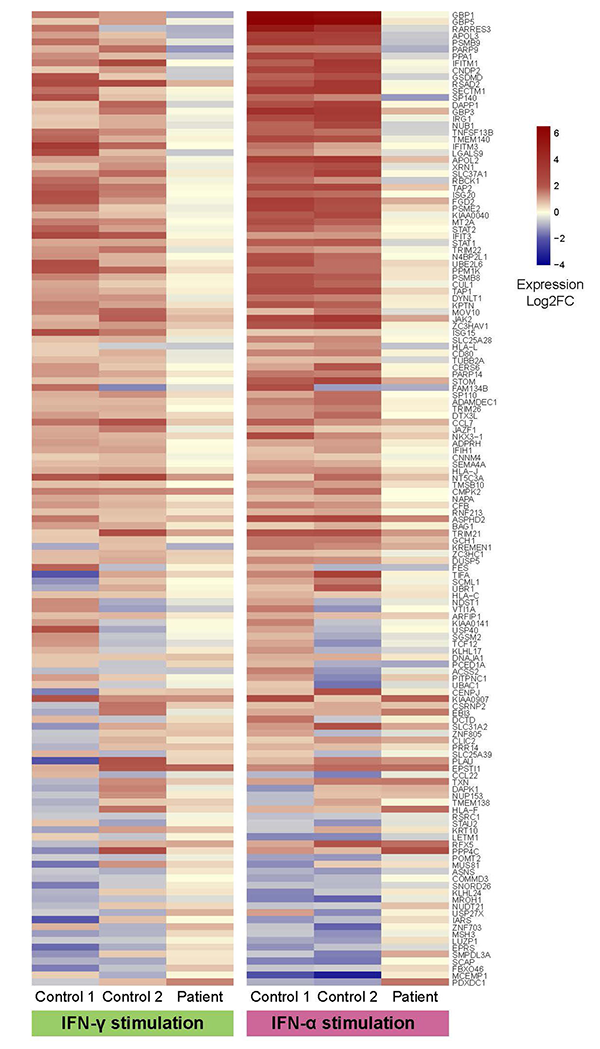
患者では、赤色、青色で示される遺伝子がコントロールと比較して著明に少なく、IFN-γ、IFN-α刺激に対する反応の障害を示唆する。
今後の展開
本研究で、イントロン領域の変異を原因とする世界初のAR-STAT1完全欠損症の症例を同定することに成功しました。WESによって診断確定に至らないPID症例に対して、ターゲットRNAシークエンスを導入することで、診断率が向上し、早期診断治療に貢献できる可能性が示されました。
注釈
- 注1:イントロン領域
- 遺伝子にはエクソンとイントロンがあり、タンパク質を作るための情報をもつ部分がエクソンで、もたない部分がイントロンに相当します。遺伝子が働く際にはイントロンが切り捨てられ、エクソンのみが繋がったmRNAが形成されたのち、タンパク質が作られます。
- 注2:複合ヘテロ接合性変異
- ヒトは、父親由来、母親由来の染色体を2本ずつペアで持っています。その2本の染色体に存在する1対の遺伝子に、それぞれ異なる変異が存在する場合、複合ヘテロ接合性変異と言います。
- 注3:RNAシークエンス
- RNAシークエンスは、遺伝子発現状態を網羅的に解析する技術です。本研究では、発現解析の対象を『PIDの発症に関与する426遺伝子群』に絞り込んだターゲットRNAシークエンスを実施しました。
- 注4:全エクソーム解析
- 疾患を引き起こす多くの変異は、ヒトゲノムの2%に満たないエクソン領域に位置することが知られています。WESは、網羅的にゲノム解析を行う手法の1つで、エクソン領域を中心に解析を行います。
- 注5:マイコバクテリア
- 細菌の一種で、結核菌、BCG、非定型抗酸菌などが含まれます。
発表論文
- 論文タイトル
- Autosomal recessive complete STAT1 deficiency caused by compound heterozygous intronic mutations
- 著者
- Sonoko Sakata, Miyuki Tsumura, Tadashi Matsubayashi, Shuhei Karakawa, Shunsuke Kimura, Moe Tamaura, Tsubasa Okano, Takuya Naruto, Yoko Mizoguchi, Reiko Kagawa, Shiho Nishimura, Kohsuke Imai, Tom Le Voyer, Jean-Laurent Casanova, Jacinta Bustamante, Tomohiro Morio, Osamu Ohara, Masao Kobayashi, Satoshi Okada*
*Corresponding Author(責任著者) - 掲載雑誌
- International Immunology
- DOI:
- 10.1093/intimm/dxaa043
お問い合わせ先
研究に関すること
広島大学 大学院医系科学研究科 小児科学 教授 岡田賢
TEL:082-257-5212 FAX:082-257-5214
E-mail:sokada“AT”hiroshima-u.ac.jp
報道(広報)に関すること
広島大学 広報部広報グループ
〒739-8511 東広島市鏡山1-3-2
TEL:082-424-3701 FAX:082-424-6040
E-mail:koho“AT”office.hiroshima-u.ac.jp
AMED事業に関すること
日本医療研究開発機構(AMED)
ゲノム・データ基盤事業部医療技術研究開発課
難治性疾患実用化研究事業
E-mail:nambyo-r“AT”amed.go.jp
E-mailは上記アドレス“AT”の部分を@に変えてください
関連リンク
掲載日 令和2年7月31日
最終更新日 令和2年7月31日


