医薬品プロジェクト 難治性疾患実用化研究事業
基本情報
| 分野 | 医薬品プロジェクト,再生・細胞医療・遺伝子治療プロジェクト,データ利活用・ライフコースプロジェクト,難病・希少疾患 |
|---|---|
| 開発フェーズ | 基礎的,応用,非臨床研究・前臨床研究,臨床試験,治験,観察研究等 |
| お問い合わせ先 |
|
概要
本事業は、「希少性」「原因不明」「効果的な治療方法未確立」「生活面への長期にわたる支障」の4要件を満たす希少難治性疾患を対象として、病因・病態の解明、画期的な診断・治療・予防法の開発を推進することで、希少難治性疾患の克服を目指すものです。なお、研究開発費の効率的活用の観点から、「がん」「生活習慣病」「精神疾患」等、他の事業において組織的な研究の対象となっている疾病等は本事業の対象としません。
公募情報
-
令和7年11月20日 終了若手あり令和8年度 (情報更新)「難治性疾患実用化研究事業」に係る公募について
-
令和7年9月2日令和7年度 「難治性疾患実用化研究事業(医療機器)」(2次公募)の採択課題について
-
令和7年5月20日 終了令和7年度 「難治性疾患実用化研究事業(医療機器)」に係る公募(2次公募)について
-
令和7年3月17日 若手あり令和7年度 「難治性疾患実用化研究事業」の採択課題について
-
令和6年10月18日 終了若手あり令和7年度 「難治性疾患実用化研究事業」に係る公募について
-
令和6年9月19日 若手あり令和6年度 「難治性疾患実用化研究事業(医療機器・ヘルスケア、疾患基礎研究)」(2次公募)の採択課題について
-
令和6年5月17日 終了若手あり令和6年度 「難治性疾患実用化研究事業(医療機器・ヘルスケア、疾患基礎研究)」に係る公募(2次公募)について
-
令和6年5月9日令和6年度 (情報更新)「難治性疾患実用化研究事業」の採択課題(1次公募)について
-
令和5年11月24日 終了令和6年度 (情報更新)「難治性疾患実用化研究事業」に係る公募(1次公募)について
-
令和5年8月3日 若手あり令和5年度 「難治性疾患実用化研究事業(ゲノム・データ基盤 、疾患基礎研究)【若手枠あり】)」(2次公募)の採択課題について
ニュース
AMEDが支援する課題の研究成果として各研究機関が発表した資料は、2026(令和8)年 成果情報一覧をご覧ください。
-
プレスリリース 令和7年11月14日医療の区分化における難病当事者の抱える困難―22q11.2欠失症候群にともなう重複障害の医療人類学的分析―
-
令和7年9月4日難治性疾患実用化研究事業における令和6年度 事後評価結果について
-
令和7年3月14日難治性疾患実用化研究事業における令和6年度 中間評価結果について
-
令和6年10月3日難治性疾患実用化研究事業における令和5年度 事後評価(第2回)結果について
-
令和6年3月27日難治性疾患実用化研究事業における令和5年度 中間評価結果について
-
令和6年3月27日難治性疾患実用化研究事業における令和5年度 事後評価結果について
-
令和5年3月14日難治性疾患実用化研究事業における令和4年度 事後評価結果について
-
プレスリリース 令和4年5月10日発症早期の筋萎縮性側索硬化症(ALS)患者さんを対象とした高用量メチルコバラミン第3相試験(JETALS)のご報告―症状の進行抑制効果が示されました―
-
プレスリリース 令和4年5月2日CDC42-C末端異常症に於ける炎症病態を解明―ゴルジ体への異常蓄積がパイリンインフラマソーム形成を過剰促進―
-
プレスリリース 令和4年4月15日新しいタイプの筋ジストロフィー治療薬の開発―発症原因を解消するプロドラッグを創出し、疾患モデルマウスの治療に成功―
事業の目標と成果
令和元年度までの第一期AMEDにおいて、本研究事業が含まれる難病克服プロジェクトでは医薬品・医療機器等の薬事承認や適応拡大を7件、欧米等のデータベースと連携した国際共同臨床研究及び治験の開始を1件、未診断又は希少疾患に対する新規原因遺伝子又は新規疾患の発見を29件達成しました。令和2年度からの第二期でも引き続き、厚生労働省および難治性疾患政策研究事業の研究班と相互に連携して切れ目無く実臨床につながる研究開発が行われるよう対応し、様々な個別の難病に関する実用化を目指した病因・病態解明、画期的な診断・治療・予防法の開発に資するエビデンス創出のためのゲノムや臨床データ等の集積、共有化、またこれらの取組による病態メカニズム理解に基づく再生・細胞医療、遺伝子治療、核酸医薬などの新規モダリティ等を含む治療法の研究開発をはじめとした研究開発を推進していきます。
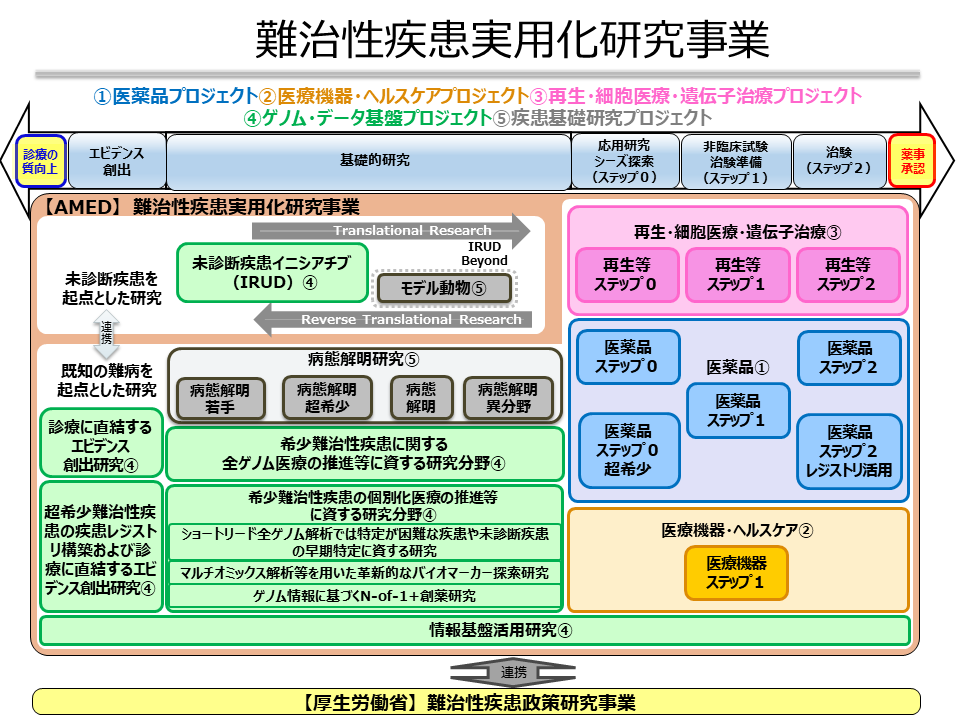
事業で扱う研究
1.希少難治性疾患に対する画期的な医薬品の実用化に関する研究(医薬品プロジェクト)
大学等による質の高い基礎的研究に立脚し、希少難治性疾患患者に寄与する優れた「成果やシーズ」を着実に実用化プロセスに乗せるため、大学等と企業等との連携を通じて、ヒトへの医療応用を目指します(原則として第II相試験まで)。
- 1-1. 医薬品のシーズ探索研究(ステップ0)
- 開発候補物の創出を目的としたスクリーニング系構築、ヒット化合物評価、構造最適化、探索的薬効評価等を行い、原則として研究期間終了時までに、治験準備に進める状況になっていることを目指します。
- 1-2. 超希少難治性疾患に対する医薬品のシーズ探索研究(ステップ0・超希少)
- 患者数が国内に1,000人未満である超希少難治性疾患を対象に、開発候補物の創出を目的としたスクリーニング系構築、ヒット化合物評価、構造最適化、探索的薬効評価等を行い、原則として研究期間終了時までに、治験準備に進める状況になっていることを目指します。
- 1-3. 医薬品の治験準備(ステップ1)
- 治験への移行を目的とした非臨床試験の実施と非臨床POC(Proof of Concept)の取得、治験用製剤の確保(治験薬のGMP製造)、治験プロトコールの作成、治験相談の実施等を行い、原則として研究開発期間終了時までに、治験へ進める状況となっていることを目指します。
- 1-4. 医薬品の治験(ステップ2)
- 治験を実施(治験計画届の提出、第I相試験の実施、第II相試験の実施、臨床POCの取得、GMP製造等)し、原則として研究開発期間終了時までに、薬事承認申請を実施する企業等への導出が成立していることを目指します。
2.希少難治性疾患に対する画期的な再生・細胞医療・遺伝子治療の実用化に関する研究(再生・細胞医療・遺伝子治療プロジェクト)
再生・細胞医療・遺伝子治療について基礎から臨床段階まで切れ目無く一貫した支援を行い、アカデミア等の有望なシーズや汎用技術などの育成を通じ画期的な診断・治療・予防法の開発を推進します。また、これらの開発研究を通じ必要な製造技術・安全性評価技術・周辺技術の実用化を目指します。
- 2-1. 再生・細胞医療・遺伝子治療のシーズ探索研究(ステップ0)
- 希少難治性疾患の再生・細胞医療・遺伝子治療の開発シーズ取得に向けて、非臨床POCを目指す研究を推進します。原則として研究開発期間終了時までに、特許出願と「再生・細胞医療・遺伝子治療の治験準備(再生等ステップ1)」に進める状況になっていることを目指します。
- 2-2. 再生・細胞医療・遺伝子治療の治験準備(ステップ1)
- 治験又は再生医療等安全確保法に基づく臨床研究を通じた保険収載を目的とした非臨床試験の実施、治験用製剤又は製品の確保、治験プロトコールの作成、治験相談の実施等を行い、原則として研究開発期間終了時までに、治験又は再生医療等安全確保法に基づく臨床研究へ進める状況となっていることを目指します。
- 2-3. 再生・細胞医療・遺伝子治療の治験(ステップ2)
- 治験を実施(治験計画届の提出、第I相試験の実施、第II相試験の実施、臨床POCの取得、GCTP製造等)し、原則として研究開発期間終了時までに、薬事承認申請を実施する企業等への導出が成立していることを目指します。
3.診療に直結するエビデンス創出研究(データ利活用・ライフコースプロジェクト)
希少難治性疾患は、その種類が多い一方で疾患ごとの症例数が少なく、診療エビデンスを創出しにくいという課題があります。健康に関し重要かつエビデンスレベルを向上させるべき希少難治性疾患の課題について、希少疾患のレジストリや医療データベースを活用したリアルワールドエビデンスの創出や診療に直結するエビデンス創出を目指す研究開等を行い、医療利用者と提供者の意思決定支援に役立つ診療エビデンスの創出を目指します。
4.希少難治性疾患に関する全ゲノム医療の推進等に資する研究(データ利活用・ライフコースプロジェクト)
厚生労働省の「全ゲノム解析等実行計画 2022」を踏まえ、格納された全ゲノム解析データや臨床情報を新規治療開発等に利活用するための技術を確立するとともに、新規治療開発等を行うのに必要な症例を戦略的に蓄積し、全ゲノム解析等の解析結果を、研究・創薬、日常診療導入実現、新たな個別化医療等実現に活用することを目指します。
5.希少難治性疾患の個別化医療の推進等に資する研究分野(データ利活用・ライフコースプロジェクト)
個々の疾患の患者数が限られている希少難治性疾患におけるゲノム医療および個別化医療を実現するためには、病態解明を含めた中長期的な研究開発が必要です。この公募枠では最先端のゲノム解析技術を活用して、より早期の疾患特定ひいては治療の可能性を拡大すること、バイオマーカーを探索し治療法開発やその効果判定に寄与しさらには将来的な発症予測・予防に繋げること、希少難病においてゲノム情報に基づいた創薬開発などを目指します。
6.希少・未診断疾患に対する診断プログラム基盤の利活用を通じた患者還元を推進する研究(データ利活用・ライフコースプロジェクト)
国内にはまだ多くの、臨床的な所見を有しながらも通常の医療では診断に至ることが困難な疾患(希少・未診断疾患)の患者が存在しており、治療法の実用化が望まれています。希少・未診断疾患患者に対し網羅的ゲノム解析を行い、ゲノム研究と基礎研究を含む様々な分野との連携を強化することで、全国レベルの患者還元体制の構築、臨床診断困難な希少疾患の診療エビデンス創出、疾患確定までの時間短縮化、同定された病因性バリアントに基づく病態解明研究の開発推進、創薬シーズの創出、国際連携を通して、希少・未診断疾患患者のより良い医療実現を目指します。
7.希少難治性疾患の研究及び実用化に資する情報基盤活用(データ利活用・ライフコースプロジェクト)
難病研究の推進には、臨床情報をはじめとした様々なデータを戦略的かつ継続的に収集し活用する情報基盤が必要です。この公募枠では、全ての指定難病の臨床情報の格納を目指した情報基盤の構築、国内外の研究機関及び企業がオープンかつフェアに利活用できるための体制の構築、研究班の規模やデータの利用目的に応じた、競争的研究資金に依存しない情報基盤の継続的な運用体制構築などにより、難病患者および家族・研究者・企業に貢献する情報基盤の完成を目指します。
8.希少難治性疾患の克服に結びつく病態解明研究(データ利活用・ライフコースプロジェクト)
発病の機構が不明で根治に至る治療法が未確立な疾患である希少難治性疾患に対して、新たな創薬標的の探索・同定による画期的な治療法や診断法をめざします。
病態解明・Research0は希少難治性疾患の病態を解明することで新規創薬標的を創出し、新規作用機序を提案します。さらに、病態解明・Research1にて、新規作用機序に適したモダリティを提案し、創薬標的が治療に繋がることを検証します。連続した2つの病態解明研究から実用化につなげます。また、若手研究者による斬新なアイデアと手法で行う病態解明・Research Y0,Research Y1を推進しています。
9.希少難治性疾患に対する画期的な医療機器の実用化に関する研究(データ利活用・ライフコースプロジェクト)
大学・研究機関等による質の高い基礎的研究に立脚し、希少難治性疾患患者のQOLや予後の向上に寄与する優れた「成果やシーズ」を着実に実用化プロセスに乗せるため、大学等と企業等との連携を通じて、ヒトへの医療応用を目指します。
- 9-1. 医療機器のシーズ探索(ステップ0)
- アカデミア、企業及び臨床医の連携を通じて、研究者が持つ独創的な技術シーズを活用した、「新しい」予防、計測、診断(AIやデータを活用した診断、低侵襲の診断等)、治療を可能とする革新的な医療機器・システムの開発を支援し、原則として研究期間終了時までに、要素技術の原理を検証、開発する医療機器・システムのコンセプト及び性能の決定、医療現場等のニーズを想定したプロトタイプ機の完成を目指します。
- 9-2. 医療機器の治験準備(ステップ1)
- 治験への移行を目的とした非臨床試験の実施と非臨床POCの取得、治験用機器の確保、治験プロトコールの作成、治験相談の実施等を行い、原則として研究開発期間終了時までに、治験または臨床試験へ進める状況となっていることを目指します。
- 9-3. 医療機器の治験(ステップ2)
- 治験を実施(治験計画届の提出、第I相試験の実施、第II相試験の実施、臨床POCの取得、QMS省令に適合した製品の製造等)し、原則として研究開発期間終了時までに、薬事承認申請を実施する企業等への導出が成立していることを目指します。
評価・運営体制
本事業は、事業の運営や各プログラムの連携協力・推進等の調整を行うプログラムスーパーバイザー(PS)と、PSを補佐して個々の課題の運営推進を行うプログラムオフィサー(PO)がマネジメントします。
プログラムスーパーバイザー(PS)
楠 進(学校法人近畿大学 名誉教授・客員教授)
プログラムオフィサー(PO)
浅井 史敏(日本獣医生命科学大学 客員教授)
五十嵐 隆(国立成育医療研究センター 理事長)
池田 貞勝(東京科学大学病院 がん先端治療部 がんゲノム診療科 教授)
稲垣 治(元・日本製薬工業協会 医薬品評価委員会 運営委員会幹事)
島田 隆(日本医科大学 名誉教授)
成川 衛(北里大学 大学院薬学研究科 教授)
茂呂 和世(大阪大学 大学院医学研究科 生体防御学教室 教授)
和田 和子(大阪母子医療センター 副院長)
渡邉 裕司(浜松医科大学 学長)
(五十音順、令和7年4月現在)
課題評価委員会
AMEDにおける評価・運営体制に一覧を掲載しているほか、以下のリンク先でもご覧いただけます。
実施機関
- AMED研究開発課題データベース「AMEDfind」で検索・閲覧いただけます。
AMEDfindは、AMEDが推進している研究開発課題について、課題名、研究者名、成果報告等の情報を検索可能なデータベースとして研究者をはじめとする一般に提供するシステムです(ご利用前に、著作権や禁止行為等について記載された利用規約をご一読ください)。
【検索方法】
「プロジェクト名・事業名・タグの選択」の枠内の「プロジェクト・事業を参照」の右の欄に 「難治性疾患実用化研究事業」と記載し「検索」ボタンを押すと、該当事業のデータが表示されます。
例えば、表示画面の左の絞り込みの欄の「研究期間」を 「2017」~「2017」にして右にあるマークをクリックすると 平成29年度の事業実施機関に絞り込むことができます。
研究成果
本事業では、研究開発課題の進捗状況および成果をご紹介する場として、年度ごとに成果報告会を開催しております。
2022年度成果報告会開催報告につきましては、下記リンクよりご紹介しております。
(ライブイベントでの講演動画も公開しております)
2022年度成果報告会「医療と研究の力で難病に光を」開催報告
研究成果報告書につきましては、あわせて下記リンクをご覧ください。
評価結果
- 令和7年度 中間評価(「全ゲノム解析等実行計画」にかかる課題)
- 令和6年度事後評価
- 令和6年度中間評価
- 令和5年度事後評価
- 令和5年度中間評価
- 令和4年度事後評価
- 令和3年度事後評価
- 令和2年度事後評価
- 平成31年度(令和元年度)事後評価
- 平成30年度事後評価
- 平成29年度事後評価
事務処理説明書
調査報告等
令和3年度 希少難治性疾患における国内外の規制対応、開発企業及び周辺環境の現状及び動向調査報告書
難治性疾患実用化研究事業は、患者に新しい治療等を研究成果として届けることを目標としています。
その点で妥当かつ最新の科学技術に基づく提案なのか、実用化を担う企業動向やニーズに合致したものか、申請予定の規制科学に合致したものなのか、患者会動向を含めた周辺環境は適切なのか等についても重要で、希少性から開発研究の実現性や市場性の観点で海外状況にも留意する必要があります。
本調査は希少難治性疾患領域において「科学技術、企業動向、規制科学、周辺環境(患者会等)」について国内外の①規制・制度・ガイドライン等を調査するマクロ調査と、②個別の品目・疾患を調査するミクロ調査、③アカデミアや企業、患者会等へのインタビュー調査結果から、希少難治性疾患の医薬品等の開発・承認に係る動向分析を行い、日本での医薬品等の開発・承認を促進させるための課題を多角的に検証しています。
関連リンク
- IRDiRC(国際希少疾患研究コンソーシアム)への加盟、活動状況
- 公開イベントの開催状況
- 国立研究開発法人科学技術振興機構(JST)戦略的研究推進事業ライフサイエンス系のプレスリリース
- 本事業ではJST戦略的研究推進事業と協力し、成果報告会などを通じて、本事業研究開発実施に資するシーズ情報を参画研究者に紹介する取り組みを行っています。
最終更新日 令和7年11月7日