プレスリリース 新しいタイプの筋ジストロフィー治療薬の開発―発症原因を解消するプロドラッグを創出し、疾患モデルマウスの治療に成功―
プレスリリース
愛媛大学
東京大学
日本医療研究開発機構
概要
この度、愛媛大学大学院医学系研究科の金川基教授、東京大学大学院医学系研究科の戸田達史教授、神戸大学大学院医学研究科の徳岡秀紀医師らの研究グループは、糖鎖異常型とよばれる筋ジストロフィーモデルマウスの治療に成功しました。
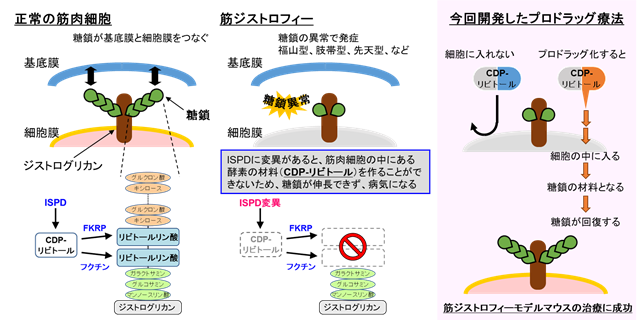
糖鎖とは核酸・タンパク質に次ぐ第三の生命鎖とよばれ、タンパク質や脂質に結合した形で機能を発揮する生体にとって重要な物質です。その重要さゆえに糖鎖の異常は時に疾患の原因になることもあります。筋ジストロフィーは筋力が進行性に低下していく遺伝性疾患で、有効な治療法が未だに確立されていない難病です。筋ジストロフィーの中には、糖鎖の異常によって発症する病型もあり、本邦の小児期筋ジストロフィーで二番目に多くみられる福山型筋ジストロフィーなどが挙げられます。糖鎖異常が生じる原因は様々ですが、糖鎖の材料となる物質の異常も筋ジストロフィーの原因となることが知られています。
本研究では、糖鎖の生合成に必要な物質のひとつCDP-リビトール(注1)の合成酵素ISPD(イソプレノイドドメイン含有タンパク質、注2)の異常によって発症する筋ジストロフィーのモデルとして、ISPDが欠損したマウスを作出し、CDP-リビトールの合成不全と糖鎖異常が発症の原因になることを明らかにしました。次いで、モデルマウスに対するISPD遺伝子治療によって病気の進行を抑制できることを発見しました。更に、細胞内への送達効率を高めたCDP-リビトールを創出し、モデルマウスのプロドラッグ(注3)治療に世界で初めて成功しました。糖鎖の生合成経路を治療標的とする薬剤の開発研究例は極めて少なく、今回の発見は糖鎖異常を発症要因とする疾患の治療法開発にむけて画期的な成果となり、筋ジストロフィーや先天性糖鎖不全症などの希少難治性疾患の治療法開発にむけて大きな貢献が期待できます(図1)。
この研究成果に関する論文は、日本時間令和4年4月14日付でNature Communications誌に掲載されました。
研究のポイント
- 筋ジストロフィーの原因となる酵素ISPDを欠損したマウスを作出し、発症にいたるメカニズムを明らかにしました。
- ISPD遺伝子治療によって、筋ジストロフィーの進行を抑制できることを発見しました。
- CDP-リビトールという糖鎖の材料をプロドラッグ化し、モデルマウスの治療に世界で初めて成功しました。
- 遺伝子治療やプロドラッグ療法は、筋ジストロフィー治療薬開発にむけた臨床応用につながると期待されます。
背景
糖鎖はタンパク質や脂質に結合した形で機能を発揮する、生体にとって重要な物質です。その重要さゆえに、糖鎖の生合成異常は疾患の原因にもなります。糖鎖の異常を原因とする疾患は、優に百種を越えます(参考1)。一方で、糖鎖の生合成系路や構造の複雑さから、ゲノムやタンパク質領域に比べ相対的に研究が遅れている感は否めませんが、糖鎖がもつ生物学的意義を読み解くことで、未知の生命現象や疾患を解明できると期待が高まっている研究分野です(参考2)。
筋ジストロフィーは進行性に筋力の低下を認める遺伝性疾患の総称で、その病型は多岐にわたります。2000年代に糖鎖の異常を認める筋ジストロフィー症例が相次いで発見され、どの症例においても共通してジストログリカンというタンパク質に糖鎖異常がみられたことから、糖鎖異常型(ジストログリカン異常症)という新しい疾患概念が確立されました。糖鎖の異常によって、ジストログリカンが担う細胞外基底膜と細胞膜の連携が破綻し、筋肉細胞が壊れやすくなると考えられています(図1)。糖鎖異常型筋ジストロフィーは、先天性の筋病変に加えて脳障害なども伴う最重篤型の筋ジストロフィーです。日本では、福山型筋ジストロフィーが最も多くみられる糖鎖異常型筋ジストロフィーで、小児期筋ジストロフィーの中では二番目に多い疾患です。福山型筋ジストロフィーの発見、その原因遺伝子フクチンの発見、そして糖鎖と疾患との関係を明確にした本研究グループの研究成果は国内外で広く認められています(参考3)。
本研究グループはこれまで、筋ジストロフィー発症の原因になる糖鎖の構造や、その生合成に関わる酵素を明らかにしてきました。中でも、リビトールリン酸という哺乳動物ではそれまで存在が知られていなかった化合物が糖鎖の中に存在していること、その生合成に関わる酵素(フクチン、フクチン関連タンパク質FKRP)、およびリビトールリン酸の材料となる物質であるCDP-リビトールとその合成酵素ISPD(イソプレノイドドメイン含有タンパク質)の発見は、マスメディアでも報道され、国際的な教科書を書き換えるインパクトを残しました(参考1、4、5)。本グループの一連の研究から、糖鎖異常型筋ジストロフィーの理解は進みましたが、有効な治療法は未だに存在せず、国内外から画期的な治療法の開発が切望されていました。
研究の成果
本研究では、糖鎖異常型筋ジストロフィーの発症メカニズムの解明と治療法の開発を目指して、ISPD遺伝子を欠損するマウスを作出しました。ISPD欠損マウスは、筋力と筋重量の低下を示し、病理学的に進行性の筋ジストロフィー様の所見を呈し、患者でみられる病変を再現していました。また、本来ISPD酵素が合成すべきCDP-リビトールの量が激減しており、その結果、糖鎖異常も生じており、これらの異常が発症要因であることが明らかになりました(図2)。
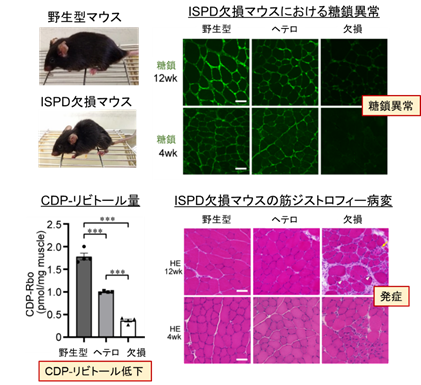
この疾患モデルマウスに対し、アデノ随伴ウイルスベクター(注4)を用いてISPD遺伝子を導入したところ、CDP-リビトール量と糖鎖が回復し、筋ジストロフィーの進行を抑制できることがわかりました。このことから、ISPD変異型筋ジストロフィーは治療可能であることが示され、同時に、CDP-リビトールを補充することで治療につながることも示唆されました。
しかし、CDP-リビトールは細胞内への送達効率が極めて低いため、そのままの形状では薬剤として利用できません。そこで、CDP-リビトールを化学的に修飾することで細胞内への送達性を高め、かつ細胞内では代謝反応によって生理活性型のCDP-リビトールへと変換できるような仕組みを施しました(プロドラッグ化)。CDP-リビトールのプロドラッグ候補化合物を十種合成し、それぞれの送達活性や生体内での毒性を検証した結果、CDP-リビトール分子上の四か所にアセチル基を導入した化合物が最も効果が高いプロドラッグであることがわかりました。そして、このプロドラッグ化合物を長期的にISPD欠損マウスに投与したところ、治療効果を発揮することが明らかになりました(図3)。
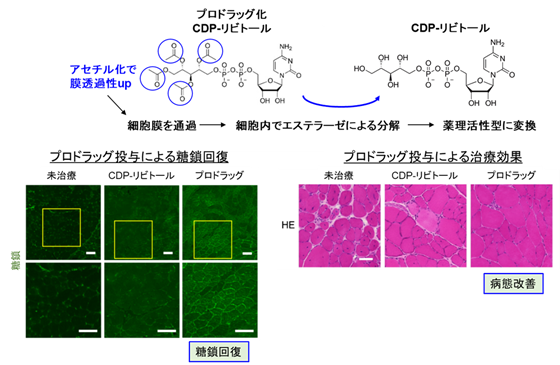
以上の結果から、ISPD変異型筋ジストロフィーに対して、遺伝子治療とCDP-リビトールプロドラッグ療法という新しい治療法の提唱にいたりました。
本研究成果が社会に与える影響(本研究成果の意義)
今回の研究成果は、遺伝子治療法やプロドラッグ療法など、筋ジストロフィー治療薬開発にむけた臨床応用につながると期待されます。遺伝子治療は疾患の原因となる遺伝子の種によって適応の可否が決まる治療法ですが、プロドラッグ療法は原因遺伝子が異なる疾患にも適応できる可能性があります。例えば、CDP-リビトールを基質として用いる酵素(フクチンやフクチン関連タンパク質FKRP)に変異がある場合でも、プロドラッグの投与により筋細胞内のCDP-リビトール濃度が増加すれば、変異酵素の活性が増大し、糖鎖回復ひいては治療につながると考えられています。福山型筋ジストロフィー(フクチン変異)の患者は国内では1千~2千人程度、フクチン関連タンパク質FKRPの変異患者は世界で数千~1万人程度存在すると推察されており、プロドラッグ療法の適応拡充が見込まれます。ISPD遺伝子に変異がある筋ジストロフィー患者も国内外で報告されておりますので、今後は、CDP-リビトールのプロドラッグ化合物の生体内安定性や細胞内への送達効率などに更なる改良を加えた後、臨床治験へと展開することが期待されます。
また、CDP-リビトールのように糖鎖の材料となる化合物(糖ヌクレオチドと呼ばれる)の生合成不全は、先天性糖鎖異常症という疾患の原因にもなります。今回開発したプロドラッグ化技術は、筋ジストロフィー以外の疾患にも応用が見込まれます。
筋ジストロフィーや先天性糖鎖異常症のような患者数の少ない希少難治性疾患は世界で7千種類以上存在するといわれていますが、患者数が少ないため治療法開発は遅れをとっていました。しかし、全世界の希少疾患患者を総計すると4億人にものぼると推定され、希少という言葉で片付けられない現状です(参考6)。事実、世界的にも希少疾患治療薬の研究開発が熱を帯びており、承認される医薬品や売り上げシェアも右肩上がりに増加しています(参考7)。今回の研究対象となったISPD変異型をはじめとする糖鎖異常型筋ジストロフィーはいずれも希少疾患です。このような背景を鑑みましても、今回の論文で発表した成果は、産学官の垣根を超えて社会的にも国際的にも意義のある研究といえます。
研究体制と支援について
本研究は、愛媛大学大学院医学系研究科、東京大学大学院医学系研究科を中心とする共同研究としておこなわれました。研究の実施にあたっては、日本医療研究開発機構(AMED)難治性疾患実用化研究事業、ならびに革新的先端研究開発支援事業ユニットタイプ「メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出」研究開発領域の支援を受けて実施しました。
論文タイトルと著者
- 掲載誌
- Nature Communications
- URL
- https://www.nature.com/articles/s41467-022-29473-4.
- DOI
- 10.1038/s41467-022-29473-4.
- タイトル
- CDP-ribitol prodrug treatment ameliorates ISPD-deficient muscular dystrophy mouse model
(和訳)CDP-リビトールのプロドラッグ治療はISPD欠損型筋ジストロフィーマウスモデルの病態を改善する - 掲載日
- (日本時間)2022年4月14日(木)18時00分
- 著者
- Hideki Tokuoka1,2, Rieko Imae3, Hitomi Nakashima1, Hiroshi Manya3, Chiaki Masuda4, Shunsuke Hoshino3, Kazuhiro Kobayashi1, Dirk J. Lefeber5, Riki Matsumoto2, Takashi Okada6, Tamao Endo3, Motoi Kanagawa1,7, and Tatsushi Toda8
徳岡秀紀1,2, 今江理恵子3, 中島瞳1, 萬谷博3, 増田千明4, 星野駿介3, 小林千浩1, Dirk J. Lefeber5, 松本理器2, 岡田尚巳6, 遠藤玉夫3, 金川基1,7, 戸田達史8 - 所属
- 1神戸大学大学院医学研究科 分子脳科学分野
2神戸大学大学院医学研究科 脳神経内科学分野
3東京都健康長寿医療センター研究所 老化機構研究チーム
4 日本医科大学 分子遺伝医学分野
5ラドバウド大学 ドンデルス脳認知行動研究所 神経学分野
6東京大学医科学研究所 分子遺伝医学分野
7愛媛大学大学院医学系研究科 医化学・細胞生物学講座
8東京大学大学院医学系研究科 神経内科学
用語説明
- (注1)CDP-リビトール
- ジストログリカンに修飾される糖鎖の中から発見された、リビトールリン酸という化合物の前駆体となる物質。ISPD(注2)という酵素によって生合成される。
- (注2)ISPD(イソプレノイドドメイン含有タンパク質)
- 変異によって筋ジストロフィーが発症する原因となるタンパク質のひとつ。細胞内でCDP-リビトールを合成する酵素。
- (注3)プロドラッグ
- 生体内で代謝されることで、薬理活性をもつ化合物に変換され作用を発揮する化合物。今回の研究では、脂溶性を上げる官能基をエステル結合でCDP-リビトールに施すことで細胞内への送達活性を高め、細胞内に到達後は、細胞内エステラーゼの作用によって官能基が切断され、もとのCDP-リビトールへと変換される化合物となっている。
- (注4)アデノ随伴ウイルスベクター
- 遺伝子治療に用いられるウイルスベクターのひとつ。様々な臨床試験に用いられている。ウイルスベクターとは、ウイルスが感染した細胞にゲノムを送り込む仕組みを利用して、目的の遺伝子を細胞へ導入するために使われる分子生物学的なツール。安全性のためにウイルスの複製能や増殖能などを欠失させる改変がなされている。
参考文献、ウェブサイト
(参考1)Essentials of Glycobiology, 3rd edition, Cold Spring Harbor Laboratory Press
(参考2)糖鎖生命コア研究拠点の「ヒューマングライコームプロジェクト」が学術研究の大型プロジェクトの推進に関する基本構想ロードマップ(案)に掲載されました(東海国立大学機構webサイト)
(参考3)2007(平成19)年度朝日賞受賞者一覧(朝日新聞社)
(参考4)Kanagawa et al. Identification of a Post-translational Modification with Ribitol-Phosphate and Its Defect in Muscular Dystrophy. Cell Rep. 2016 Mar 8;14(9):2209-2223. doi: 10.1016/j.celrep.2016.02.017.
(参考5)平成29年日本学士院賞
(参考6)Allies in Rare Disease - Global Genes
(参考7)EvaluatePharma Orphan Drug Report 2020
本件に関する問い合わせ先
研究に関すること
愛媛大学大学院医学系研究科
教授 金川 基(かながわ もとい)
TEL:089-960-5248 FAX:089-960-5251
E-mail:kanagawa.motoi.fa”AT”ehime-u.ac.jp
東京大学大学院医学系研究科
教授 戸田 達史(とだ たつし)
TEL:03-5800-6542 FAX:03-5800-9829
E-mail:toda”AT”m.u-tokyo.ac.jp
報道に関すること
愛媛大学医学部総務課企画・広報チーム
達川 優菜
TEL:089-960-5943/5119
Email:mekoho”AT”stu.ehime-u.ac.jp
東京大学医学部附属病院 パブリック・リレーションセンター
渡部 晃子、小岩井 理美香
TEL:03-5800-9188 (直通)
FAX:03-5800-9193(直通)
E-mail:pr”AT”adm.h.u-tokyo.ac.jp
AMED事業に関するお問い合わせ
日本医療研究開発機構
難治性疾患実用化研究事業担当
E-mail:nambyo-r”AT”amed.go.jp
革新的先端研究開発支援事業担当
Email:kenkyuk-ask”AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和4年4月15日
最終更新日 令和4年4月15日


