事務処理説明書・様式集、研究開発実施上の留意事項 再生医療研究事業の進捗管理における留意事項について(再生医療研究事業のマネジメントに関するチェック項目について)
概要
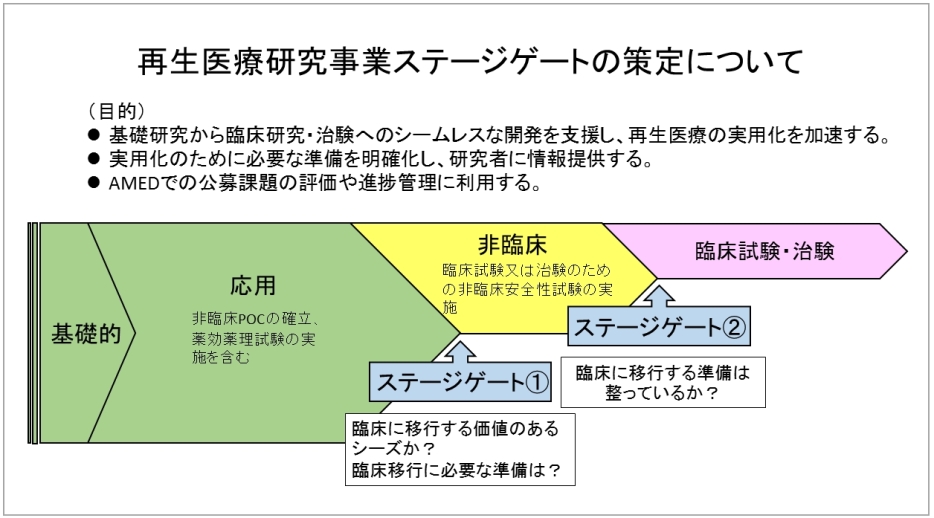
医薬品の分野においては、「研究マネジメントに関してのチェック項目(医薬品)」が作成され、平成30年度から、採択予定の研究課題を対象にチェック項目の確認がパイロット的に実施されています。これを受け、再生医療等の分野においても、適切な時点(ステージゲート)において、それまでの進捗状況等にかかる評価(Go/no-go判断)を個別に行うことで、AMEDの研究開発支援の成果を一層高めるとともに、研究費の効果的な配分・使用に資することを目的として、チェック項目を作成しました。
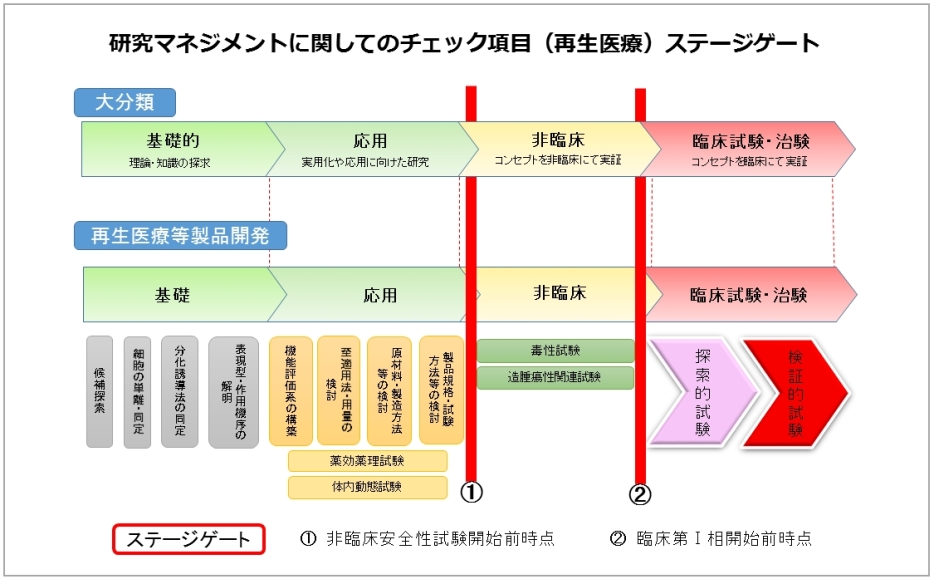
チェック項目は、以下の二つの要素から構成され、各項目は、それぞれのステージゲートまでに達成しておくべき必要最低限の要求事項を整理したものとなります。
① ターゲット又はシーズそのものの評価等に関すること
② 研究環境等(例えば、知的財産や研究体制等の検討状況や今後の見込み等)に関すること
なお、個別の研究開発課題において検討した際に、チェック項目を満たさない場合であっても、次のステージに進むことが可能な合理的な理由を説明することで次のステージに進むことができるものとします。
ステージゲートは、次の図に示すステージゲート①(非臨床安全性試験開始前時点)とステージゲート②(臨床第Ⅰ相開始前時点)の2時点を設定しています。
再生医療研究において、有望なシーズが見つかった際には、まずステージゲート①のチェック項目を確認することで、臨床に移行するために必要な準備項目がわかるようになっています。
また、実際に臨床試験・治験フェーズに入ろうとする研究については、ステージゲート②のチェック項目を確認することで、臨床に移行する準備が整っているかを確認できるようになっています。
チェック項目の対象
AMEDで公募する課題のうち、多能性幹細胞(iPS/ES細胞)、体性幹細胞又は遺伝子改変細胞を用いた再生医療等の実用化にかかる研究開発課題が対象となります。
運用について
運用例として、非臨床安全性試験を実施するための研究課題と臨床試験・治験を実施するための研究課題において想定される研究開発提案書の雛形案を提示します。
非臨床安全性試験を実施するための研究課題を評価する際には、ステージゲート①のチェック項目がどれくらい満たされているかを評価する必要がありますので、当該情報が研究開発提案書から得られるように工夫しています。
- ステージゲート①用雛形の例(黄色マーカー部分と別添2がチェック項目に関連する部分です。)
臨床試験・治験を実施するための研究課題を評価する際には、ステージゲート②のチェック項目がどれくらい満たされているかを評価する必要がありますので、当該情報が研究開発提案書から得られるように工夫しています。
- ステージゲート②用雛形の例(黄色マーカー部分と別添3、4がチェック項目に関連する部分です。)
参考情報
チェック項目を満たすために必要な方策等がご不明な場合には、再生医療等実用化基盤整備促進事業にて支援している「再生医療ナショナルコンソーシアム」をご活用いただくことも可能です。以下URLから「再生医療ナショナルコンソーシアム」で行っている支援内容をご覧いただけます。
問い合わせ先
「再生医療ナショナルコンソーシアム」臨床研究技術支援担当
E-Mail:crs"AT"jsrm.jp
※E-mailは上記アドレス”AT”の部分を@に変えてください。
掲載日 平成30年6月8日
最終更新日 令和7年4月10日


