再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生・細胞医療・遺伝子治療産業化促進事業)
基本情報
| 分野 | 再生・細胞医療・遺伝子治療プロジェクト,がん,難病・希少疾患,成育,生活習慣病・老年医学,認知症・精神・神経疾患,感染症,その他の疾患 |
|---|---|
| 開発フェーズ | 非臨床研究・前臨床研究 |
| お問い合わせ先 |
|
概要
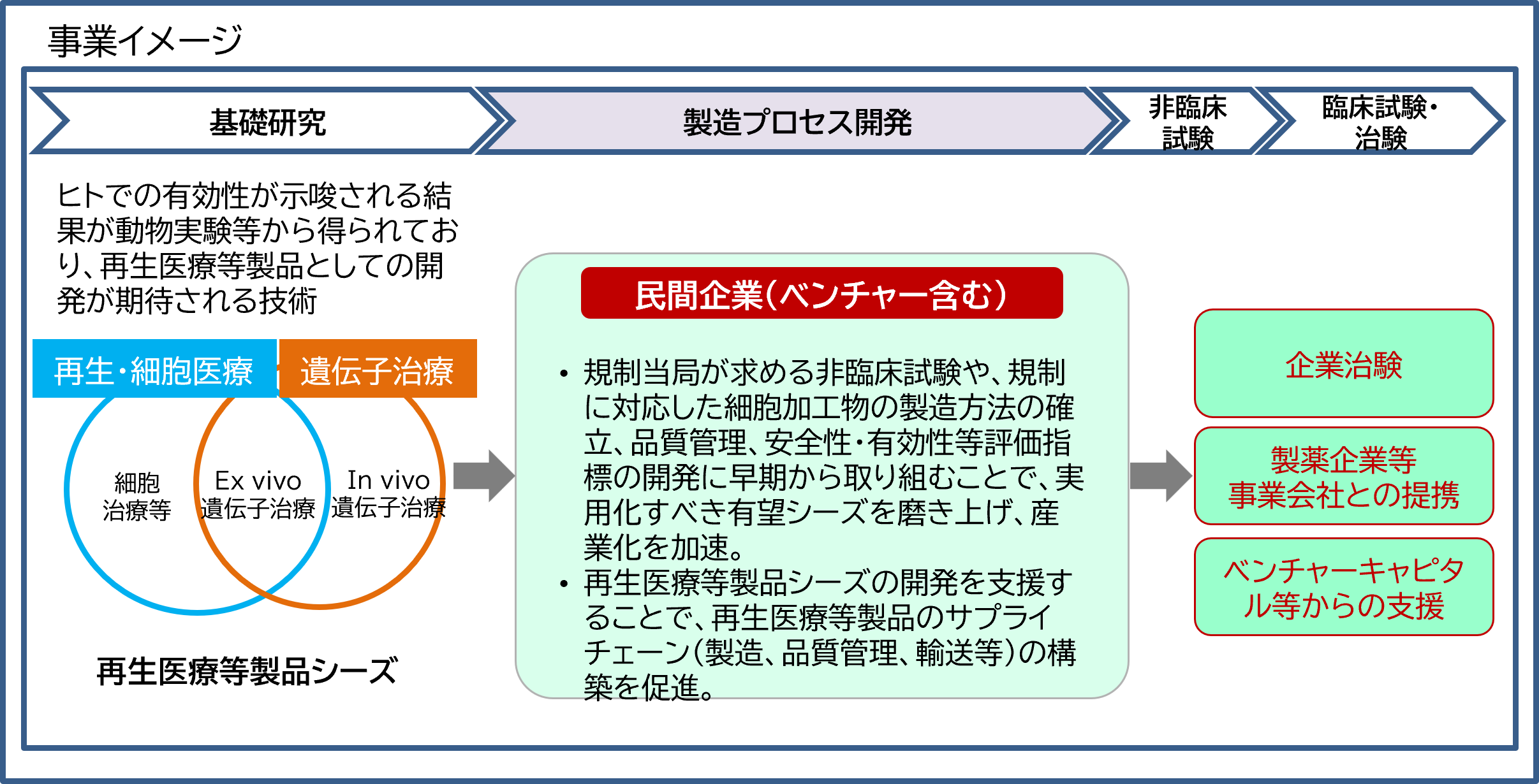
近年、iPS細胞、ES細胞、体性幹細胞等の幹細胞を用いた再生・細胞医療、in vivo遺伝子治療又は遺伝子を導入した細胞を用いるex vivo遺伝子治療は、臨床現場において新たな治療の選択肢となり、国民の健康増進に大きく寄与することから、市場の急速な拡大が予想され、国際競争も激化しています。
本事業は、産業化を見据えた再生医療等製品シーズに対し、開発の主体となる企業(ベンチャー等を含む)が企業治験に求められる薬事規制に沿った非臨床試験の実施や製造方法の確立、評価指標を開発するため、CMO/CDMOやCROと連携し薬事対応を意識した開発体制の構築等を通し、当該企業の有するシーズの価値を高めるための支援を行います。また、当該シーズ技術の普及にあたって、必要となる再生医療等製品のサプライチェーン(製造、品質管理、輸送等)の構築も促進します。この研究開発を通じて、再生医療等製品シーズの価値を高めて、企業治験等の臨床開発だけでなく、将来的にはベンチャー・キャピタル等からの支援資金調達や他の製薬企業等への導出を促進することを目指します。
公募情報
-
令和8年2月16日 終了令和8年度 (情報更新)「再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生・細胞医療・遺伝子治療産業化促進事業)(開発補助事業)」に係る公募について
-
令和7年11月17日令和7年度 「再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生・細胞医療・遺伝子治療産業化促進事業)(開発補助事業)」の採択課題について
-
令和7年5月23日 終了令和7年度 (情報更新)「再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生・細胞医療・遺伝子治療産業化促進事業)(開発補助事業)」に係る公募について
-
令和6年12月6日令和6年度 「再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生・細胞医療・遺伝子治療産業化促進事業)(開発補助事業)」の採択課題について
-
令和6年5月28日 終了令和6年度 「再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生・細胞医療・遺伝子治療産業化促進事業)(開発補助事業)」に係る公募について
-
令和6年5月1日令和6年度 「再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生・細胞医療・遺伝子治療産業化促進事業)(委託事業)」の採択課題について
-
令和6年2月14日 終了令和6年度 「再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生・細胞医療・遺伝子治療産業化促進事業(委託事業))」に係る公募について
-
令和5年9月22日令和5年度 「再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生・細胞医療・遺伝子治療産業化促進事業)(開発補助事業)」の採択課題について
-
令和5年3月22日 終了令和5年度 (情報更新)「再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生・細胞医療・遺伝子治療産業化促進事業)(開発補助事業)」に係る公募について
-
令和4年10月5日令和4年度 「再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生・細胞医療・遺伝子治療産業化促進事業)(開発補助事業)」の採択課題について
ニュース
AMEDが支援する課題の研究成果として各研究機関が発表した資料は、2026(令和8)年 成果情報一覧をご覧ください。
-
令和8年2月6日再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生・細胞医療・遺伝子治療産業化促進事業)における事後評価結果(令和6年度終了課題)について
-
令和7年3月10日再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生・細胞医療・遺伝子治療産業化促進事業)における事後評価結果(令和5年度終了課題)について
-
令和7年1月8日再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生・細胞医療・遺伝子治療産業化促進事業)における中間評価結果について
-
令和5年12月15日再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生・細胞医療・遺伝子治療産業化促進事業)における事後評価結果(令和4年度終了課題)について
-
イベント 令和4年11月21日公開シンポジウム・講演会「知ろうx語ろう 軟骨再生医療のこれから-細胞シートを用いた変形性膝関節症の治療研究の最前線-」開催のお知らせ(AMED協賛イベントのご案内)
実施機関
令和7年度採択課題
| 研究開発課題名 | 研究代表機関 | 研究開発代表者 | 所属・役職 |
|---|---|---|---|
| 網膜変性疾患に対する細胞療法のためのゲノム編集iPS細胞および高機能網膜シートの製造プロセス開発 | 株式会社RACTHERA | 石川 泰三 | 視機能再生グループマネージャー |
| 遺伝性難聴を標的とした内耳遺伝子治療用アデノ随伴ウイルスの製造プロセス開発 | 株式会社ギャップジャンクション | 神谷 和作 | 代表取締役 |
| 新規マイクロキャリア大量培養技術を利用したデザイナー骨格筋芽細胞治療の製造及び品質管理のためのCDMOとの共同研究開発 | 株式会社 Hyperion Drug Discovery | 嶽北 和宏 | 代表取締役社長 |
| 後期治験および商業製造に向けたiPS細胞由来T細胞製造法の構築、および商用化まで協業可能な分化誘導CDMOの立ち上げに関する研究開発 | シノビ・セラピューティクス株式会社 | 等 泰道 | 代表取締役 |
令和6年度採択課題
| 研究開発課題名 | 研究代表機関 | 研究開発代表者 | 所属・役職 |
|---|---|---|---|
| iPS細胞由来膵島細胞を用いた1型糖尿病に対する細胞治療の商用製造に向けたプロセス開発 | オリヅルセラピューティクス株式会社 | 伊藤 亮 | 事業部長 |
| 受容体標的化腫瘍溶解性ヘルペスウイルスの大量製造プロセス開発 | 株式会社 Good Hero Therapeutics |
内田 宏昭 | 部長 |
| CRISPR-Cas3ゲノム編集技術を用いた先天性代謝異常症に対する細胞療法の製造プロセス開発 | C4U株式会社 | 岡田 聖裕 | センター長 |
| 研究開発課題名 | 研究代表機関 | 研究開発代表者 | 所属・役職 |
|---|---|---|---|
| HLCN061(遺伝子導入iPS細胞由来NK細胞)の悪性胸膜中皮腫を対象とした治療方法創出のための研究開発 | 株式会社ヘリオス | 木村 博信 | 部長 |
| 重症栄養障害型表皮水疱症に対する根治的遺伝子治療技術開発 | 株式会社ステムリム | 玉井 克人 | 取締役最高科学責任者 (CSO) |
| GPC-1陽性再発・難治固形癌に対する新規GPC-1 CAR-T療法の開発 | 株式会社リプロセル | 横山 周史 | 代表取締役社長 |
令和5年度採択課題
| 研究開発課題名 | 研究代表機関 | 研究開発 代表者 |
所属・役職 |
|---|---|---|---|
| 自家iPS細胞由来再生心室筋細胞移植による難治性重症心不全治療法の開発 | Heartseed株式会社 | 福田 恵一 | 代表取締役 |
| ヒト脂肪細胞由来血小板様細胞(ASCL-PLC)の輸血用血小板としての開発 | 株式会社AdipoSeeds | 松原 由美子 | 取締役 |
| ヒトiPS 細胞由来腎前駆細胞を用いた慢性腎臓病(CKD)に対する細胞療法の開発 | リジェネフロ株式会社 | 森中 紹文 | 代表取締役 |
(研究開発代表者50音順)
再生医療等製品の海外展開(米国、欧州)に向けた調査報告
創薬ベンチャー企業等が海外展開(米国、欧州)を目指すにあたり、当該国・地域の規制要件に関する情報不足が一つの課題となっています。その結果、米国食品医薬品局(Food and Drug Administration:FDA)や欧州医薬品庁(European Medicines Agency:EMA)から、製造方法や品質規格の再設定、非臨床試験および臨床試験の再実施を求められ、これらの対応に伴い開発資金が不足する、開発期間が遅延する、といった問題が生じています。こうした状況により、創薬ベンチャー企業等が海外展開に踏み出せず、再生医療等製品の産業化における大きな障壁の一つとなっています。
本調査では、再生医療等製品の開発に関連する各規制当局(日本、米国、欧州)における治験届、承認申請、相談業務、実用化促進制度について調査を行いました。あわせて、創薬企業ベンチャー等が海外展開(米国、欧州)にあたり重要と考える情報についてのニーズ調査も実施しました。
委託先:株式会社野村総合研究所
再生医療等製品のデータ利活用推進に係る調査報告
再生医療等製品の多くは、開発過程において、①臨床データ数が少ない、②製造コストが非常に高額、③低分子製品のような大規模前向き臨床試験は困難、という背景があります。そのため、少ない臨床データと製品製造データを連結させ、データの比較検証を通じ新たな知見を生む製法開発基盤の必要性が期待されています。一方、開発段階のものや、有効性・安全性が確立されていない再生医療等製品においても、製法開発基盤の効果を利用した有効性・安全性の高い製品製造につながることが望まれています。また、臨床データと製品製造データの連結から生まれる新知見は、製品製造メーカーへのメリットとして、CQA:Critical Quality Attribute(製品の品質を保証するために、物理的、化学的、生物学的、微生物学的特性のうち、適切な範囲内にあるべき特性)の発掘や、デザインスペース:Design Space(品質を保証できる入力変数、プロセスパラメーターの多次元的な組合せ、及びそれらの相互作用)の拡大、それらによる製造コストの削減が期待できるところです。
本調査では、再生医療等製品(本調査では、治験準備段階にある薬事承認前のものを含む。)の臨床データと、製品生産時に得られる製造・品質データを紐付け、それらの相関を解析することで、再生医療等製品の製品製造過程における品質向上、コストダウン及び有効性向上などに資する具体的事例(ユースケース)について調査・検討しました。加えて、特定した有用なユースケースを前提に、実際にデータを紐付け、相関解析を行うシステムの構築可能性を検討し、システムへの要求事項の概要についても調査検討し、結果をまとめました。
委託先:三菱UFJリサーチ&コンサルティング
運営体制
- プログラムスーパーバイザー(PS)
- 梅澤 明弘 国立成育医療研究センター 研究所 所長
- プログラムオフィサー(PO)
- 稲垣 治 元日本製薬工業協会 医薬品評価委員会 運営委員会幹事
佐藤 陽治 国立医薬品食品衛生研究所 副所長
評価結果
最終更新日 令和8年2月6日


