プレスリリース CDC42-C末端異常症に於ける炎症病態を解明―ゴルジ体への異常蓄積がパイリンインフラマソーム形成を過剰促進―
プレスリリース
京都大学
東北大学
日本医療研究開発機構
概要
私達の身体には、病原体を認識し排除するシステムとして「自然免疫」という即時型の反応が備わっています。自然免疫の代表的な仕組みの1つに、病原体に特徴的なタンパク質などの“分子パターン”を認識して炎症を引き起こす「インフラマソーム」(後述)の形成があります。正常な状態では、病原体の種類に応じて特定のインフラマソームが形成されて適切な炎症が誘導されますが、自然免疫の調節機構の障害により過剰な炎症が引き起こされる場合があります。発熱、皮膚炎、関節炎など、リウマチや膠原病に類似した症状が認められ「自己炎症性疾患」と呼ばれています。
京都大学大学院医学研究科の八角高裕 准教授と伊佐(西谷)真彦 同博士課程学生(研究当時)、東北大学大学院医学系研究科の笹原洋二 准教授、及び東北大学大学院生命科学研究科の田口友彦 教授と向井康治朗 同助教らの共同研究グループは、近年報告されたCDC42遺伝子のC末端突然変異による自己炎症性疾患の原因が、パイリンインフラマソームの過剰形成である事を解明しました。変異CDC42タンパク質が異常なパルミトイル化[注1]を受けてゴルジ体に蓄積すると、パイリンインフラマソームの形成が促進されて炎症誘導物質であるIL-1βやIL-18が過剰産生される事が明らかになりました。今回の発見は、未解明の部分が多いパイリンインフラマソーム形成過程の全容解明へ新たな視点を提供し、新規治療法開発への足掛かりになることが期待されます。
本成果は、2022年4月28日(現地時刻)に米国の国際学術誌「Journal of Experimental Medicine」にオンライン掲載されました。
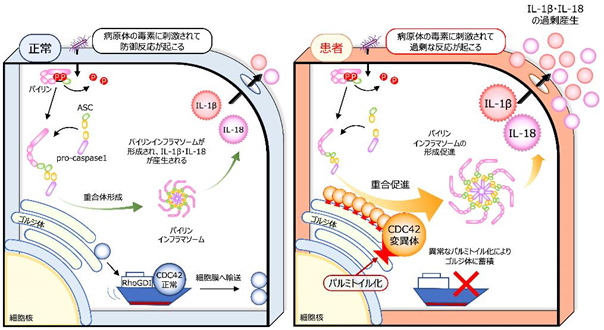
背景
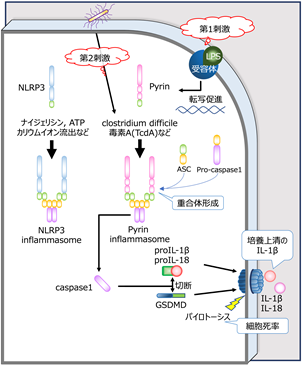
病原体を認識・排除する自己防衛システムである自然免疫に関わる機構に“インフラマソーム”があります。これは、侵入してきた細菌の毒素やペプチドに反応する細胞質センサー、アダプター分子であるASC(アポトーシス関連スペック様タンパク質)、及び蛋白切断分子の前駆体であるpro-caspase 1からなる複合体です。細胞質センサーにはパイリン(Pyrin)やNLRP1、NLRP3、NLRC4 などがあり、各々が決まった成分に対する防御を担っています。各種センサー分子に刺激が入るとインフラマソームが重合し、caspase-1が切り出されて活性化します。活性化caspase-1は、IL(インターロイキン[注2])-1βとIL-18を各々の前駆体から切り出したり、Gasdermin D(GSDMD)を切断して活性化させたりします。GSDMD断片は細胞膜に孔を開けてパイロトーシス(pyroptosis)[注3]というプログラム細胞死を誘導し、これによりIL-1βやIL-18などの炎症を惹起する物質が放出されます(図1)。
自己炎症性疾患は、自然免疫の異常な反応を原因とする疾患であり、繰り返す発熱や関節炎、皮疹などの症状が認められます。代表的な疾患に家族性地中海熱(FMF)が挙げられ、この場合の原因はパイリン分子の変異です。異常なパイリン分子は刺激に過剰反応、あるいは無刺激下で自発的に活性化してインフラマソームを形成し、発作性の発熱、腹痛や胸痛、関節炎や皮疹などを引き起こします。
近年、新しい自己炎症性疾患が次々と報告されていますが、CDC42-C末端異常症というCDC42遺伝子の突然変異を原因とする疾患が2020年に報告され、我々もCDC42R186C変異を有する2症例を経験しました。海外からの報告例と同様、出生直後より重篤な炎症を認め、ステロイドなどによる炎症抑制を行いましたが救命する事は出来ませんでした。CDC42はGTPをGDPに加水分解する酵素であるGTPアーゼ(GTPase)の1つであり、細胞膜に局在してシグナルを伝えるスイッチの役割を果たします。しかし、CDC42分子のC末端変異が炎症を引き起こす機構は未解明でした。
研究手法・成果
本研究では、患者さん由来のiPS細胞[注5]からマクロファージ[注6](iPS-MP)を分化・作成し、炎症病態の評価を行いました。CDC42R186C変異の患者血液中でIL-1βやIL-18が上昇していたことからインフラマソーム形成を介した自己炎症性疾患である事を疑い、様々な刺激への反応を確認してどのインフラマソームが活性化しているかを調べました。その結果、患者由来のiPS-MPはパイリンの特異的刺激物質であるClostridium difficile毒素A(TcdA)に対して特異的に過剰反応することが判明しました(図2)。
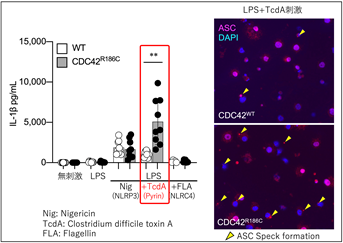
(右)インフラマソーム形成の指標である“ASCスペック”が患者由来細胞に多く認められます。
タンパク質は、遺伝子からポリペプチド鎖に変換された後にリン酸、糖鎖、脂質などが付加される“翻訳後修飾”というものを受けます。CDC42R186Cでは変異が起きた186番目のシステインに異常なパルミトイル化が起こり、細胞内での分布が変わることが報告されていました。またCDC42-C末端異常症の原因としてCDC42C188YとCDC42X192Cも報告されていたため併せて評価しました。その結果、CDC42X192CはCDC42R186Cと同様にゴルジ体に異常集積し、CDC42C188Yは細胞膜に局在できないことがわかりました(図3)。パルミトイル化阻害薬である2-ブロモパルミチン酸(2-bromopalmitate; 2-BP)によりゴルジ体への集積は解除されました。
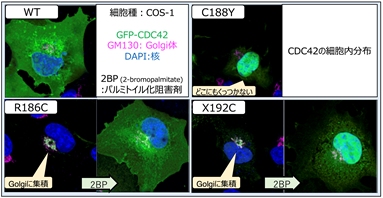
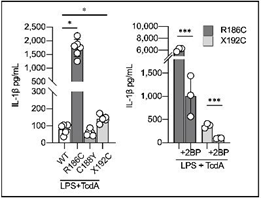
続いて、CRISPR-Cas9[注7]技術を用いて野生型iPS細胞にCDC42R186C、CDC42C188Y、CDC42X192Cの遺伝子変異を導入し、iPS-MPを作成して炎症の評価を行いました。ゴルジ体への異常集積が確認されたCDC42R186CとCDC42X192CではIL-1βの過剰産生が起こり、2BPで改善しました。一方、CDC42C188YではIL-1βの過剰産生は認められませんでした(図4)。更に、ゴルジ体に集積したCDC42分子によるパイリンインフラマソームの過剰形成は、CDC42分子のGTPアーゼとしての働きとは無関係である事も確認されました。
波及効果、今後の予定
CDC42-C末端異常症は稀ではあるものの致死的な疾患です。抗IL-1β療法が奏功したという報告はありますが、今後はパイリンインフラマソームの特異的阻害剤の開発が焦点になると思われます。パイリンインフラマソームは他のインフラマソームと比較して機能解析が進んでいませんが、今回の結果からCDC42の局在異常が過剰活性化を引き起こすことが判明し、その活性化や制御機構を解明する重要な一歩になると考えます。
研究プロジェクトについて
本研究は、科学研究費助成事業[課題番号:21K07795, 20H03202, 19H00974]、日本医療研究開発機構(AMED)難治性疾患実用化研究事業[課題番号:JP20ek0109387]、AMED再生医療実現拠点ネットワークプログラム(疾患特異的iPS細胞の利活用促進・難病研究加速プログラム) [課題番号:JP21bm0104001, JP21bm0804005, JP19bm0804001]、AMED革新的先端研究開発支援事業PRIME[課題番号:JP20gm5910025]、厚生労働科学研究費補助金(難治性疾患政策研究事業)、持田記念医学薬学振興財団、等の支援により行われました。
用語解説
- [注1]パルミトイル化
- タンパク質翻訳後修飾の一種であり、パルミチン酸などの脂肪酸をタンパク質のシステイン残基に共有結合させる反応のこと。タンパク質の輸送やタンパク質間の相互作用に関わっている。
- [注2]IL(インターロイキン)
- 白血球などから分泌されるタンパク質の総称で、細胞同士の情報伝達を担うものである。現時点で30種類以上が発見されている。
- [注3]パイロトーシス(pyroptosis)
- インフラマソームの活性化により引き起こされる特徴的な細胞死。
- [注4]LPS:Lipopolysaccharide
- 主にグラム陰性菌の外膜に存在する糖脂質の1種。細胞表面の受容体に結合することで、シグナル伝達経路を活性化させて炎症を引き起こす。
- [注5]iPS細胞(人工多能性幹細胞)
- 脊椎動物の初期胚などが持つ、全ての種類の体細胞へ分化する能力である「多能性」を持ち、培養して無限増殖が可能である細胞を多能性幹細胞という。iPS細胞は、ヒトの血液や皮膚の細胞に幾つかの遺伝子を導入して作製した多能性を持つ幹細胞の一つである。
- [注6]マクロファージ
- 骨髄由来の免疫細胞の一種。病原体を貪食・分解する活性が強い細胞であり、免疫の初期応答、特に炎症の惹起に関わる中心的な細胞である。
- [注7]CRISPR-Cas9
- DNA配列中の狙った部分を切断できる遺伝子改変手法。切断したい部分に結合するように短い塩基配列を設計し、DNA切断酵素であるCas9 タンパクを発現させる遺伝子配列と同時に細胞に導入することで、DNA配列の狙った部分を切断・編集することが可能となる。
論文タイトルと著者
- タイトル
- Trapping of CDC42 C-terminal variants in the Golgi drives pyrin inflammasome hyperactivation(CDC42 C末端端変異体のゴルジ体への集積はパイリンインフラマソームを過剰に活性化させる)
- 著者
- Masahiko Nishitani-Isa*, Kojiro Mukai*, Yoshitaka Honda, Hiroshi Nihira, Takayuki Tanaka, Hirofumi Shibata, Kumi Kodama, Eitaro Hiejima, Kazushi Izawa, Yuri Kawasaki, Mitsujiro Osawa, Yu Katata, Sachiko Onodera, Tatsuya Watanabe, Takashi Uchida, Shigeo Kure, Junko Takita, Osamu Ohara, Megumu K. Saito, Ryuta Nishikomori, Tomohiko Taguchi, Yoji Sasahara#, Takahiro Yasumi#(*共筆頭著者、#共責任著者)
- 掲載誌
- Journal of Experimental Medicine
- DOI
- 10.1084/jem.20211889
お問い合わせ先
八角 高裕(やすみ たかひろ)
京都大学大学院医学研究科発達小児科学・准教授
E-mail:yasumi”AT”kuhp.kyoto-u.ac.jp
報道・取材に関するお問い合わせ先
京都大学 総務部広報課国際広報室
TEL:075-753-5729 FAX:075-753-2094
E-mail:comms”AT”mail2.adm.kyoto-u.ac.jp
東北大学大学院医学系研究科・医学部広報室
東北大学病院広報室
TEL:022-717-7149 FAX:022-717-8931
E-mail:press”AT”pr.med.tohoku.ac.jp
AMED事業に関するお問い合わせ先
日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課
TEL:03-6870-2224
E-mail:kenkyuk-ask”AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和4年5月2日
最終更新日 令和4年5月2日


