不整脈源性心筋症の病態(心筋収縮力の低下、デスモゾーム形成異常)をヒトiPS細胞由来分化心筋細胞により解明
成果情報
大阪大学大学院医学系研究科
日本医療研究開発機構
研究成果のポイント
- PKP2(プラコフィリン2)※1変異により発症する不整脈源性心筋症※2症例から作製したヒトiPS細胞由来分化心筋細胞を用いてヒト疾患モデルを確立し、PKP2遺伝子変異がデスモゾーム(介在板)※3形成異常に関与することを見いだした。
- アデノ随伴ウイルスを用いたPKP2遺伝子補充により、細胞と細胞をつなぐデスモゾームが回復する過程を可視化し、心筋細胞の収縮力が改善することを明らかにした。
- 不整脈源性心筋症に対する遺伝子治療概念を実証したことにより、新たな治療法の開発が期待される。
概要
大阪大学大学院医学系研究科の肥後修一朗特任准教授(常勤)(重症心不全内科治療学)、宮川繁教授(心臓血管外科学)、坂田泰史教授(循環器内科学)らの研究グループは、不整脈源性心筋症の病態をヒトiPS細胞由来分化心筋細胞により解明しました(図1)。
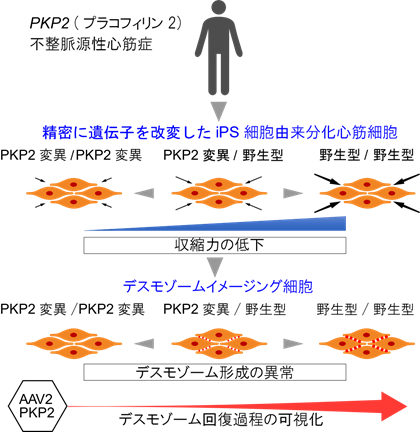
今回、研究グループは、不整脈源性心筋症症例からiPS細胞を樹立し、ゲノム編集技術を用いて、発症原因であるPKP2遺伝子変異を精密に改変した細胞(PKP2変異/野生型、野生型/野生型、PKP2変異/PKP2変異)を作製しました。作製した3種のiPS細胞を各々シート状に拍動する心筋細胞に分化させ、機能を解析した結果、PKP2タンパク質の減少に伴い、収縮力が低下すること、デスモゾームの形成異常が生じることを見出しました。さらに、ゲノム編集を用いて、生きた細胞においてデスモゾーム動態を可視化するiPS分化心筋細胞を構築しました。この細胞にアデノ随伴ウイルスによるPKP2遺伝子補充を行い、デスモゾーム回復過程を可視化するとともに、収縮力が改善することを見出しました。このように、不整脈源性心筋症における遺伝子治療概念を実証したことから、今後、不整脈源性心筋症に対する新たな治療法開発が期待されます。
本研究成果は、「Stem Cell Reports」に、2022年1月21日(金)1時に公開されました。
研究の背景
不整脈源性心筋症は、主にゲノム遺伝子異常による心筋の障害から、致死性不整脈による突然死や心不全に至る重篤な疾患群として定義されます。細胞と細胞をつなぐデスモゾームを構成する遺伝子の変異は、不整脈源性心筋症の発症原因となることが知られ、なかでもPKP2遺伝子変異は、最も高頻度に同定されています。不整脈源性心筋症では、不整脈とともに心筋収縮力の低下を来しますが、その詳細な分子メカニズムは明らかでなく、その病態を再現し得る精密なヒト疾患モデルの確立が必要でした。
本研究の成果
研究グループは、PKP2遺伝子の2つの対立遺伝子のうち片方だけに変異があるヘテロ接合型フレームシフト変異※4により不整脈源性心筋症を発症した症例から、iPS細胞(PKP2変異/野生型)を樹立しました。さらにゲノム編集を用いて、ヘテロ接合型変異を正常に修復したiPS細胞(野生型/野生型)、及び両方の対立遺伝子にフレームシフト変異を導入したiPS細胞(PKP2変異/PKP2変異)を作製しました(図2上段)。これら遺伝背景が同一の3種のiPS細胞を各々心筋に分化させ、シート状に拍動する心筋の経時的なモーションベクトル解析※5により、PKP2タンパク質の減少に伴い、心筋収縮力が低下、興奮伝播が障害されることが明らかとなりました(図2中段)。さらに、デスモゾームタンパク質であるDSG2(デスモグレイン2)が、PKP2の完全欠損により細胞の辺縁から脱落すること、PKP2の半分量への減少により形成阻害を来すことが明らかとなりました(図2下段)。
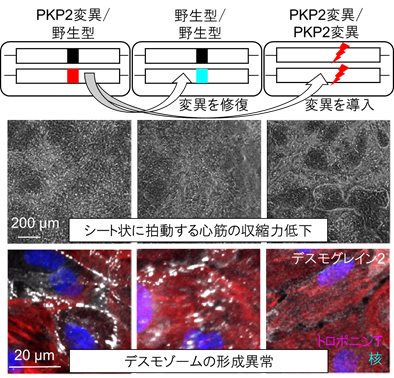
(中段)PKP2タンパク質の減少に伴い収縮力が低下し、完全欠失細胞(右)ではシートに穴のような構造が見られる
(下段)PKP2完全欠失細胞(右)ではDSG2(白)が細胞の辺縁から脱落している
デスモゾーム動態をより詳細に解析するため、構築した3種のiPS細胞に、さらに各々ゲノム編集を行い、DSG2遺伝子の片方のアレル※6に特異的に赤色蛍光タンパク質(tdTomato)を挿入したイメージングiPS細胞を3種樹立しました。タイムラプスイメージング※7を行うことで、iPS細胞から心筋細胞への分化の過程におけるデスモゾームの変化、拍動する心筋細胞におけるデスモゾームの動態を、生きた細胞で観察することが可能となりました(図3)。
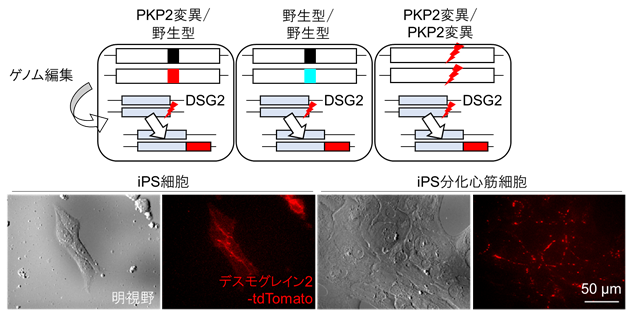
蛍光標識されたDSG2-tdTomato融合タンパク質は内在性遺伝子と同様の挙動を示し、PKP2欠損によるデスモゾーム形成低下が拍動心筋において観察されました。PKP2変異iPS分化心筋細胞、デスモゾームイメージングiPS分化心筋細胞にアデノ随伴ウイルス(AAV)を用いてPKP2遺伝子を導入したところ、低下した収縮力が改善し、脱落したデスモゾームが回復する過程が経時的に観察されました(図4)。
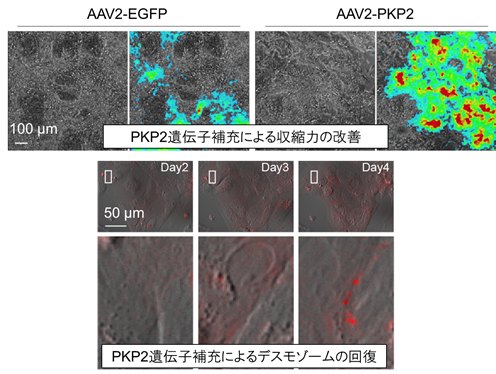
(下段)PKP2補充により、欠失細胞では脱落していたDSG2(赤)の辺縁部への集積が起こり、デスモゾームの回復が見られた
本研究成果が社会に与える影響(本研究成果の意義)
不整脈源性心筋症には既存の心不全治療薬が奏功せず、進行した場合、心臓移植しか治療方法が残されていません。本研究ではPKP2タンパク質が欠損したiPS分化心筋細胞を用いて、その病態解明を行い、遺伝子補充の治療概念を実証しました。精密に遺伝子を改変した不整脈源性心筋症モデル細胞、及びデスモゾームを可視化するイメージング細胞は、難治性心筋症に対する今後の治療法開発において、有用なプラットフォームを提供すると考えられます。
特記事項
本研究成果は、2022年1月21日(金)1時(日本時間)【2022年1月20日(水)11時(米国東部時間)】に米国科学誌「Stem Cell Reports」(オンライン)に掲載されました。
- タイトル
- “Modeling Reduced Contractility and Impaired Desmosome Assembly due to Plakophilin-2 Deficiency using Isogenic iPS Cell-Derived Cardiomyocytes”
- 著者名
- Hiroyuki Inoue1,#, Satoki Nakamura2,#, Shuichiro Higo3,*, Mikio Shiba2, Yasuaki Kohama4, Takumi Kondo1, Satoshi Kameda1, Tomoka Tabata1, Shota Okuno1, Yoshihiko Ikeda5, Junjun Li6,7, Li Liu6,7, Satoru Yamazaki8, Maki Takeda6, Emiko Ito6, Seiji Takashima9, Shigeru Miyagawa6, Yoshiki Sawa6, Shungo Hikoso1, Yasushi Sakata1
- 所属
- 1)大阪大学大学院医学系研究科 循環器内科学
2)大阪警察病院
3)大阪大学大学院医学系研究科 重症心不全内科治療学共同研究講座
4)独立行政法人国立病院機構 大阪南医療センター
5)国立循環器病研究センター 病理部
6)大阪大学大学院医学系研究科 心臓血管外科学
7)大阪大学大学院医学系研究科 組織再生デザイン学
8)国立循環器病研究センター 分子薬理部
9)大阪大学大学院生命機能研究科 医化学
#: 共同第一著者
*: 責任著者 - 掲載URL
- https://www.cell.com/stem-cell-reports/fulltext/S2213-6711(21)00655-X#%20
- DOI
- 10.1016/j.stemcr.2021.12.016
なお、本研究は日本医療研究開発機構(AMED)の再生医療実現拠点ネットワークプログラム(疾患特異的iPS細胞の利活用促進・難病研究加速プログラム)「難治性心筋症疾患特異的iPS細胞を用いた集学的創薬スクリーニングシステムの開発と実践」、日本学術振興会科学研究費助成事業の助成を得て行われました。
用語説明
- ※1 PKP2(プラコフィリン2)
- デスモゾームを構成するタンパク質の一つで、デスモグレイン2、デスモコリン2、デスモプラキンといった他のデスモゾーム構成タンパク質と結合し、細胞間接着を担う。
- ※2 不整脈源性心筋症
- 主にゲノム遺伝子異常による心筋の障害から、致死性不整脈による突然死や心不全に至る重篤な疾患群として定義される。若年者やアスリートの死亡原因となるため、社会的にも大きな問題とされる。デスモゾームを構成する遺伝子群の変異により発症すること、拡張型心筋症の一部に本疾患群が潜在化していることが知られている。
- ※3 デスモゾーム(介在板)
- 細胞と細胞の間に存在する構造で、細胞どうしをつなぎとめ、収縮する力を伝達する役割がある。
- ※4 フレームシフト変異
- 遺伝子変異のために、遺伝子からタンパク質へ翻訳される際の読み枠がずれることにより、正常なタンパク質が産生されなくなる変異。
- ※5 モーションベクトル解析
- 拍動する心筋細胞の動画像をもとに、設定された検出点の動きベクトルを解析することで、非侵襲的に心筋の収縮速度、収縮力、伝播速度を測定する解析法。
- ※6 アレル
- ヒトの細胞には、父由来、母由来の2つの染色体が存在し、それぞれの染色体上にセットとして存在する遺伝子や一塩基多型などを総称してアレルと呼ぶ。
- ※7 タイムラプスイメージング
- 顕微鏡などを用いて静止画像を一定の間隔で連続して撮影することで、時間経過による対象の変化を観察する方法。
本件に関する問い合わせ先
研究に関すること
肥後修一朗(ひごしゅういちろう)
大阪大学 大学院医学系研究科 重症心不全内科治療学共同研究講座 特任准教授
TEL:06-6210-8260 FAX:06-6210-8261
E-mail:higo-s“AT”cardiology.med.osaka-u.ac.jp
報道に関すること
大阪大学大学院医学系研究科 広報室
TEL:06-6879-3388 FAX:06-6879-3399
Email:medpr“AT”office.med.osaka-u.ac.jp
AMED事業に関すること
日本医療研究開発機構(AMED)
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
再生医療実現拠点ネットワークプログラム(疾患特異的iPS細胞利活用促進・難病研究加速プログラム)
TEL:03-6870-2220
E-mail:saiseinw“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和4年1月31日
最終更新日 令和4年1月31日


