「絶食」と「老化」で共通の機構がはたらく―オートファジーの活性化で肝臓に脂肪が蓄積―
成果情報
大阪大学
日本医療研究開発機構
研究成果のポイント
- 絶食時、脂肪組織から中性脂肪が放出され、肝臓がその中性脂肪を取り込み、緊急時の栄養として重要なケトン体※1を産生する。しかしながら、これまでその詳細なメカニズムは不明であった。
- 絶食時に脂肪組織でオートファジー※2が活性化し、その結果、脂肪組織が減少して肝臓に脂肪が蓄積することが判明した。
- 老化でも、脂肪組織でのオートファジー過剰が脂肪肝を引き起こすことがこれまでに判明しており、脂肪組織では老化と絶食で共通する機構が働くことが明らかになった。
概要
大阪大学大学院医学系研究科の山室禎研究生(研究当時、同研究科遺伝学。現ハーバード大学博士研究員)、高等共創研究院の中村修平准教授(大学院医学系研究科遺伝学/大学院生命機能研究科細胞内膜動態研究室)及び大学院生命機能研究科の吉森保教授(細胞内膜動態研究室/大学院医学系研究科遺伝学)のグループは大学院医学系研究科の下村伊一郎教授(内分泌代謝内科学)らと共同で、脂肪細胞で絶食に伴いオートファジーが活性化し、肝臓での脂肪蓄積とケトン体産生を促すこととその背景にあるメカニズムを明らかにしました。
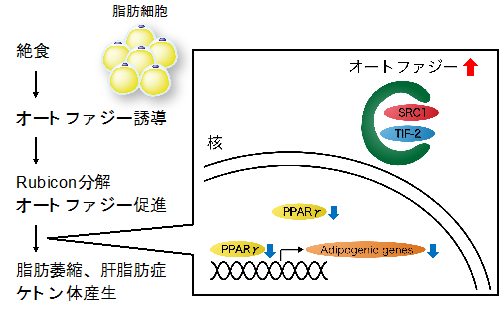
研究グループはこれまでに、脂肪組織で老化に伴いオートファジーが過剰となり、脂肪肝を引き起こすことを明らかにしていました。今回、絶食時においても脂肪組織のオートファジーが活性化することを見出しました。さらに、オートファジーが活性化することで脂肪組織が減少し、その分の脂肪が肝臓に移行し、ケトン体産生に利用されていることも明らかにしました。また、脂肪組織で活性化したオートファジーは、SRC-1、TIF2※3という脂肪の蓄積に重要な2つのタンパク質を分解していることが判明しました。つまり、絶食時にオートファジーが活性化すると脂肪細胞は脂肪を蓄積できなくなり、その結果として肝臓での脂肪蓄積が進むと考えられます(図1)。このメカニズムは老化時にも働き、生活習慣病の原因となりうることが以前の研究で明らかになっており、脂肪組織では老化と絶食で共通する機構が働くことを示唆しています。これにより、老化に伴う生活習慣病の病態理解がさらに進むことが期待されます。
本研究成果は、米国科学誌「Autophagy」に、2022年3月14日(月)に公開されました。
研究の背景
普段、脂肪細胞は余剰な栄養を取り込み、中性脂肪として自らに貯蔵しています。個体が飢餓に晒されると、脂肪細胞は中性脂肪を外に放出して、サイズが小さくなります(脂肪萎縮)。放出された中性脂肪は肝臓に取り込まれ蓄積します(肝脂肪症)。さらに、肝臓は中性脂肪を用いて、緊急時の栄養として重要なケトン体を産生します。この過程において、脂肪細胞が中性脂肪の行き先を自らから外へと変化させるステップが重要であると考えられましたが、その機構の理解は進んでいませんでした。
オートファジーは細胞内の分解機構であり、不要な構造物を分解することで細胞の健康を維持しています。そのため、がんや神経変性疾患など、様々な疾患に対してオートファジーは抑制的に働くことが示されています。一方で、本研究グループは2009年にオートファジー抑制因子であるRubicon※4を同定しており、老化した脂肪細胞ではRubiconが著減し、過剰なオートファジーが健康を害することを明らかにしてきました(なぜ老化は生活習慣病を引き起こすのか?|リソウ)。しかしながら、同時に脂肪細胞のRubiconが絶食時にも減少することも見出されており、その意義は不明のままでした。
研究の内容
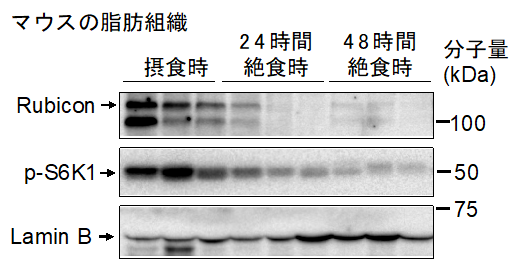
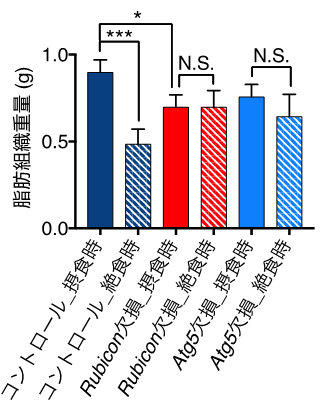
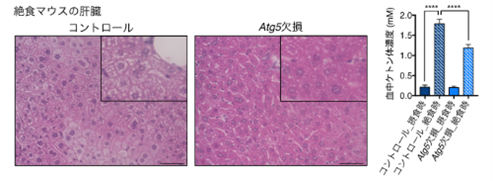
まず、Rubiconが絶食に伴い顕著に減少することを確認しました。同時に、もう一つのオートファジー抑制因子であるmTORC1※5が不活性化していることも見出しました(図2)。そのため、絶食時に脂肪細胞のオートファジーは活性化していると考えられました。次に、脂肪細胞でRubiconを欠損し、オートファジーが上昇したマウスの脂肪組織量を調べました。すると、野生型マウスは絶食時に顕著な脂肪組織量の減少を示しますが、オートファジーが上昇したマウスは絶食させなくても、同程度の脂肪組織量の減少を示しました。逆に、脂肪細胞でオートファジーを抑制したマウスは、絶食させても脂肪組織量が減少しにくいことが分かりました(図3)。さらに、このマウスでは絶食時において、肝臓での脂肪蓄積と血中ケトン体の増加が顕著に抑制されていました(図4)。これらの結果から、脂肪細胞でのオートファジー活性化が、絶食時の肝臓での脂肪蓄積とケトン体産生に重要であると考えられます。また、絶食した個体の脂肪組織では、脂肪の蓄積に重要な働きをするSRC-1、TIF2が、活性化したオートファジーによって分解されていることが判明しました。つまり、絶食時にオートファジーが活性化すると脂肪細胞は脂肪を蓄積できなくなり、その結果として肝臓での脂肪蓄積が進むと考えられます。さらに、絶食時にはRubiconもオートファジーによって分解されているということが明らかになりました。すなわち、絶食時にオートファジーが誘導されると、抑制因子であるRubiconが分解されて、更にオートファジーが促進されるという仕組みがあると推測されます(図1)。本研究で、絶食時にRubiconの分解・減少によりオートファジーが促進され、脂肪細胞が脂肪を蓄積できなくなることで肝臓での脂肪蓄積・ケトン体産生が進むことが明らかになりました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究グループは以前の研究で、老化に伴うオートファジー過剰が脂肪細胞での脂肪貯蔵を妨げること、その分の脂肪が肝臓に蓄積すること(脂肪肝)を突き止めていました。今回の研究結果から、この機構は本来、絶食時の肝臓での脂肪蓄積・ケトン体産生のために存在していると考えられます。つまり、脂肪細胞の老化とは、絶食時の反応が通常時にも働いてしまうことである可能性が示唆されます。絶食時にはオートファジーの活性化以外にも様々な機構が働くことが知られているため、今回の研究を端緒として脂肪細胞老化の研究が加速されることが期待されます。
特記事項
本研究成果は、2022年3月14日(月)に米国科学誌「Autophagy」(オンライン)に掲載されました。
- タイトル
- “Loss of Rubicon in adipocytes mediates the upregulation of autophagy to promote the fasting response”
- 著者名
- Tadashi Yamamuro1, 10, Shuhei Nakamura1, 2, 3*, Kyosuke Yanagawa1, 4, Ayaka Tokumura1,Tsuyoshi Kawabata1, 2, 5, Atsunori Fukuhara6, 7, Hirofumi Teranishi8, Maho Hamasaki1, 2, Iichiro Shimomura6 and Tamotsu Yoshimori1, 2, 9*(*共同責任著者)
- 所属
-
- 大阪大学 大学院医学系研究科 遺伝学
- 大阪大学 大学院生命機能研究科 細胞内膜動態学
- 大阪大学 高等共創研究院
- 大阪大学 大学院医学系研究科 循環器内科学
- 長崎大学 原爆後障害医療研究所
- 大阪大学 大学院医学系研究科 内分泌・代謝内科学
- 大阪大学 大学院医学系研究科 肥満脂肪病態学
- 日本たばこ産業株式会社 医薬探索研究所
- 大阪大学 先導的学際研究機構 生命医科学融合フロンティア研究部門
- 現所属先:Beth Israel Deaconess Medical Center, Harvard Medical School
- DOI
- 10.1080/15548627.2022.2047341
なお、本研究は日本医療研究開発機構(AMED)「老化メカニズムの解明・制御プロジェクト」、文部科学省科学研究費補助金によりサポートされる研究の一環として行われました。
用語説明
- ※1 ケトン体
- 絶食時に中性脂肪が分解され、脂肪酸とグリセロールに変換される。脂肪酸が更に分解されることでアセチルCoAとなり、これを材料としてアセト酢酸、3-ヒドロキシ酪酸、アセトンが合成される。これらをケトン体と総称している。基本的に脳はブドウ糖しか栄養として利用できないが、ブドウ糖が十分に利用できなくなる絶食オートファジー時には、ケトン体を栄養として利用することが知られている。
- ※2 オートファジー
- 細胞内の主要な分解系であり、不要なタンパク質や細胞内小器官(小胞体、ミトコンドリアなど)を分解することで健康を維持している。そのため、オートファジーはがんや神経変性疾患、心不全など、様々な疾患に対して抑制的に働くと考えられている。オートファジーでは、隔離膜と呼ばれる扁平な膜が現れ、分解基質を取り囲みながら伸張し、端が閉じることでオートファゴソームを形成する。分解酵素に富んだリソソームがオートファゴソームと融合することで、内容物を分解する。
- ※3 SRC-1、TIF2
- PPARγというタンパク質が脂肪細胞において極めて重要であり、栄養の取り込みや貯蔵に関わる多数のタンパク質を制御している。SRC-1、TIF2はPPARγに結合し、その働きを助けることで、脂肪の貯蔵に寄与している。NCOA1、NCOA2という別名でも知られている。
- ※4 Rubicon
- 本研究グループの吉森教授らが2009年に発見したタンパク質である。オートファゴソームとリソソームの融合に必須な働きをするPI3K複合体に結合し、その働きを抑えることで、オートファジーを負に制御している。老化に伴い脂肪細胞のRubiconが減少し、オートファジーが過剰となり、脂肪肝や糖尿病の原因となりうることが示されている。Run domain Beclin-1 Interacting and cysteine-rich containing protein。
- ※5 mTORC1
- ブドウ糖や脂肪酸、アミノ酸などの小さな分子から炭水化物や脂肪、タンパク質などの大きな分子を合成する過程を同化作用といい、mTORC1は同化作用を司る主要制御因子として知られる。mTORC1は同化作用を促進する一方で、分解系であるオートファジーを負に制御している。mechanistic Target Of Rapamycin Complex 1。
本件に関するお問い合わせ先
研究に関すること
吉森 保(よしもり たもつ)
大阪大学 大学院医学系研究科 遺伝学/生命機能研究科 細胞内膜動態学 教授
TEL:06-6879-3588 FAX:06-6879-3589
E-mail:tamyoshi”AT”fbs.osaka-u.ac.jp
研究者総覧 - 大阪大学
中村 修平(なかむら しゅうへい)
大阪大学 大学院医学系研究科 遺伝学/生命機能研究科 細胞内膜動態学/高等共創研究院 准教授
TEL:06-6879-3588 FAX:06-6879-3589
E-mail:shuhei.nakamura”AT”fbs.osaka-u.ac.jp
報道に関すること
大阪大学大学院医学系研究科 広報室
TEL:06-6879-3387 FAX:06-6879-3399
E‐mail:medpr”AT”office.med.osaka-u.ac.jp
AMED事業に関すること
日本医療研究開発機構(AMED)
老化メカニズムの解明・制御プロジェクト
疾患基礎研究事業部 疾患基礎研究課
TEL:03-6870-2286
E-mail:aging”AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和4年4月20日
最終更新日 令和4年4月20日


