プレスリリース がんゲノムビッグデータから喫煙による遺伝子異常を同定―1年間毎日1箱の喫煙によって肺では150個の突然変異が蓄積―
プレスリリース
国立研究開発法人国立がん研究センター
国立研究開発法人理化学研究所
国立研究開発法人日本医療研究開発機構
本研究成果のポイント
- 国際共同研究により、喫煙との関連が報告されている17種類のがん5,243症例のがんゲノムデータを元に喫煙と突然変異との関連について検討を行った。
- 生涯喫煙量と突然変異数には正の相関が見られ、喫煙が複数の分子機構を介してDNAに突然変異を誘発していることを明らかにした。特に、肺がんでの突然変異数が最も多く、1年間毎日1箱のたばこを吸うことで、150個の突然変異が肺に蓄積していると推計された。
- 喫煙による突然変異には少なくとも3パターンがあり、臓器により異なることが明らかになった。
国立がん研究センター研究所がんゲノミクス研究分野 柴田龍弘分野長、十時泰ユニット長、理化学研究所(理研)統合生命医科学研究センターゲノムシーケンス解析研究チームの中川英刀チームリーダー、藤本明洋客員研究員、米国ロスアラモス国立研究所Ludmil B. Alexandrov博士、英国サンガー研究所Michael Stratton所長らの日英米韓国際共同研究グループは、様々な臓器がんにおけるDNA(遺伝子)異常に喫煙がどの程度影響を及ぼしているのかについて、喫煙との関連が報告されている17種類のがんについて合計5,243例のがんゲノムデータを元に検討を行いました。
その結果、生涯喫煙量とその患者さんのがん細胞に見られる突然変異数には統計的に有意な正の相関が見られ、喫煙が複数の分子機構を介してDNA変異を誘発していることを明らかにしました。また、1年間毎日1箱のたばこを吸うことで、肺がんでは最多の150個、喉頭では97個、咽頭では39個、口腔では23個、膀胱では18個、肝臓では6個の突然変異が蓄積していると推計されました。
また変異パターン*1の解析から、喫煙によって発がんリスクが上昇するがんには少なくとも3つのタイプが存在することが明らかになりました。タイプ1はたばこ由来発がん物質暴露が直接的に突然変異を誘発しているがん(例:肺がん、喉頭がん、肝臓がん)、タイプ2はたばこ由来発がん物質暴露が間接的に突然変異を誘発しているがん(例:膀胱がん、腎臓がん)、タイプ3は今回の解析で明らかな変異パターンの増加が認められなかったがん(例:子宮頸がん、膵がん)です。
本研究成果によって、がんの発症において喫煙が全ゲノム解読レベルで突然変異を誘発していることが再確認され、がんの予防における禁煙の重要性が強調されます。さらに、今回たばこ由来発がん物質暴露が間接的に突然変異を誘発するタイプのがんが認められたことで、今後喫煙がどのように間接的な突然変異誘発機構を活性化するのかに関する詳細な分子機構の解明によって、喫煙関連がんの予防や治療が進むことが期待されます。
また本研究で用いられた解析手法によって、他の発がんリスク要因(肥満、食事等の生活習慣)についても、その背景になる分子実体の解明からがん予防戦略を加速する鍵の解明が期待されます。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)革新的がん医療実用化研究事業「国際連携を基盤とした日本人難治固形がんゲノム統合解析による新たな治療標的の同定と予防戦略への展開研究」および国立研究開発法人国立がん研究センターがん研究開発費の支援を受け、国際がんゲノムコンソーシアム(ICGC)*2のプロジェクトの一環として行われました。
研究成果は、国際科学雑誌『Science』(11月3日付け:日本時間11月4日)に掲載されました。
背景
喫煙とがんの関連について
日本におけるたばこを吸う人のがんで死亡するリスクは、吸わない人に比べて男性で2倍、女性で1.6倍、がん種別にみると男性では喉頭がん、尿路がん、肺がんで5倍前後と高く、女性では肺がんで4倍、子宮頸がん、口唇・口腔・咽頭がんで2倍以上と高くなっています。(添付資料2:日本における喫煙とがん死亡についての相対リスクと人口寄与危険割合−3コホート併合解析研究1983年~2003年)喫煙は、さまざまながんの原因の中で、予防可能な最大の原因ですが、日本でのがんの死亡のうち、男性で40%、女性で5%は喫煙が原因と考えられています。特に肺がんは喫煙との関連が強く、肺がんの死亡のうち、男性で70%、女性で20%は喫煙が原因と考えられています。
たばこに含まれる発がん物質は約60種類あり、その多くは体内の酵素で活性化された後、DNAと結合し、遺伝子の変異を引き起こします。こうした遺伝子の変異が、がん遺伝子、がん抑制遺伝子などに蓄積することによって、細胞ががん化すると考えられていますが、突然変異の誘発機構やがん種による違いなど明らかになっていなことも多く、これらを明らかにすることで、喫煙関連がんの予防や治療に更に貢献することが期待されます。
国際協力によるがんゲノム解析
近年の次世代シークエンス*3技術進歩により、様々ながんにおける遺伝子異常の全体像が解明されています。喫煙と関連するがんについても、肺がん、食道がん、口腔・咽頭部がん、膵臓がん・肝臓がん・子宮がん・膀胱がんなどの臓器がんについて、全ゲノムあるいは全エクソンシークエンスが行われ、各症例に見られる突然変異がゲノム全体のレベルで同定されています(文献1)。
中でも、国際がんゲノムコンソーシアムでは、現在、日本・英国・米国を含め17カ国が参加し、国際協力によって78のがんゲノムプロジェクトが進められ、すでに16,000例を超えるがんサンプルにおける遺伝子異常のデータが蓄積され、研究者が自由に使えるデータとして公開されています(www.icgc.org)。日本からは、国立がん研究センター、理化学研究所、東京大学が連携し、アジアにおいて重要ながんである肝臓がん、胆道がん、胃がんについて、大規模ながんゲノム解読データを解読・公開し、国際貢献を果たしています。
ビッグデータ解析による変異パターンの同定と喫煙との関連
国際がんゲノムコンソーシアム内の国際共同研究により、7,000例を超えるがんゲノム解読データを用いて、特徴的な突然変異パターン(mutation signatureと呼ばれる)の同定が網羅的に行われ、これまでに30を超える特徴的なパターンが発見されています(文献2)。このパターンの約半数は既知の発がん要因(喫煙、紫外線、DNA修復異常、肝臓がんの原因として知られるアフラトキンB1暴露等)との関連が強く見られたことから、個々の発がん要因はヒトの遺伝子において特徴的な突然変異パターンを誘発すると考えられています。
その中でも喫煙と強く相関する変異パターンとしてシグネチャー4が同定されており、実際培養細胞をたばこ由来の発がん物質(benzo[a]pyrene)で処理した後に、その細胞で発生した突然変異パターンを調べると、ヒトのがんで見られたシグネチャー4と非常に類似した変異パターンが認められました(図1)。
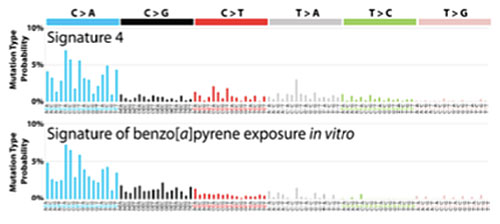 図1 ヒトがんから抽出されたシグネチャー4(上)とたばこ由来の発がん物質(benzo[a]pyrene)で処理した細胞で見られる変異パターン(下)は非常に類似する。
図1 ヒトがんから抽出されたシグネチャー4(上)とたばこ由来の発がん物質(benzo[a]pyrene)で処理した細胞で見られる変異パターン(下)は非常に類似する。
- (文献1)
- Whole-genome mutational landscape and characterization of noncoding and structural mutations in liver cancer. Nat Genet. 2016, 48:500-9.
- (文献2)
- Signatures of mutational processes in human cancer. Nature. 2013, 500:415-21
研究手法と成果
1.喫煙と遺伝子変異数との関連
全てのがんのデータを合わせた比較において、喫煙者に発症したがんでは、非喫煙者に発症したがんと比較して、統計的に有意に遺伝子変異の数が多いことが分かりました(P=0.0043)。
個々のがんでの比較では、肺がん(腺がん)、喉頭がん、口腔がん、膀胱がん、肝臓がん、腎臓がんにおいて、喫煙者において統計的に有意な突然変異数の増加を認めました。(表1 黄色で示している) また、喫煙量から計算すると、1年間毎日1箱喫煙することで、平均すると肺では150個、喉頭では97個、咽頭では39個、口腔では23個、膀胱では18個、肝臓では6個の突然変異が蓄積していると推計されました。
|
組織型 |
非喫煙者 症例数 |
喫煙者 症例数 |
喫煙者症例における突然変異増加 (統計値, P-value) |
1年間毎日1箱喫煙した場合の遺伝子変異数 |
|---|---|---|---|---|
|
肺がん(小細胞がん) |
3 |
145 |
0.82 |
150 |
|
肺がん(扁平上皮がん) |
7 |
168 |
0.7 |
|
|
肺がん(腺がん) |
120 |
558 |
2.67E-31 |
|
|
喉頭がん |
6 |
117 |
0.0094 |
97 |
|
咽頭がん |
27 |
49 |
0.75 |
39 |
|
口腔がん |
98 |
265 |
0.048 |
23 |
|
食道がん(扁平上皮がん) |
99 |
193 |
0.6 |
- |
|
食道がん(腺がん) |
67 |
175 |
0.64 |
- |
|
膀胱がん |
111 |
288 |
0.0025 |
18 |
|
肝臓がん |
157 |
235 |
0.0000079 |
6 |
|
胃がん |
472* |
ND |
- |
|
|
急性白血病 |
202* |
ND |
- |
|
|
卵巣がん |
458* |
ND |
- |
|
|
子宮頸部がん |
94 |
74 |
0.88 |
- |
|
腎臓がん |
154 |
103 |
0.0033 |
- |
|
膵がん |
119 |
120 |
0.68 |
- |
|
大腸がん |
559* |
ND |
- |
|
|
小計 |
1,062 |
2,490 |
0.0043 |
- |
2.喫煙と変異パターンとの関連(表2、図2、図3)
変異パターンと喫煙歴について検討を行ったところ、喫煙関連のシグネチャー4を含んだ5つの変異パターン(シグネチャー2, 4, 5, 13, 16)が喫煙者のがんにおいて有意に増加しているのを認めました。これをがん種ごとに検討すると、喫煙によって発がんリスクが上昇するがんには少なくとも以下の3つのタイプが存在することが明らかとなりました。
今回明らかとなった、たばこ由来発がん物質暴露が間接的に突然変異を誘発するタイプ2は、喫煙に伴い臓器特異的にある種の変異パターンによる突然変異が増加することが、喫煙リスクの原因の一部となっていることが推測されます。
タイプ1:たばこ由来発がん物質暴露が直接的に突然変異を誘発しているがん
(例:肺がん、喉頭がん、肝臓がん)
タイプ2:たばこ由来発がん物質暴露が間接的に突然変異を誘発しているがん
(例:膀胱がん、腎臓がん)
タイプ3:今回の解析で明らかな変異パターンの増加が認められなかったがん
(例:子宮頸がん、膵がん)
シグネチャー4は、たばこ由来の発がん物質に暴露したことで直接的に誘発される変異パターンであることから、まずシグネチャー4について検討を行ったところ、以下の結果が示されました。
- シグネチャー4は、肺がん(腺がん並びに扁平上皮がん)と喉頭部がんにおいて、有意に喫煙者に多く認められました。つまり、これらのがんにおいては、喫煙による直接的な発がん物質暴露が突然変異を誘発し、がんが発生していると考えらます。また直接喫煙に曝露しているわけではありませんが、肝臓がんにおいても喫煙者においてシグネチャー4が有意に増加していました。
- 一方、喫煙が発がんリスクとなることが知られている膀胱がん、子宮頸部がん、腎臓がん、膵がんでは喫煙者患者が含まれているにもかかわらずシグネチャー4は検出されませんでした。また、喫煙歴のデータはありませんが、胃がん、大腸がん、急性白血病においてもシグネチャー4は検出されませんでした。これらの臓器がんは、たばこ由来の発がん物質暴露が間接的に突然変異を誘発し、発がんリスクとなっていることが推測されました。
シグネチャー4以外に、細胞分裂回数と相関して増えると考えられているシグネチャー5は、全てのがんを合わせた場合、肺がん(扁平上皮がん・腺がん)、喉頭がん、咽頭部がん、口腔がん、食道がん、膀胱がん、肝臓がん、腎臓がんにおいて、喫煙者に統計的に有意に増加を認めました。また肺腺がんにおいては、シグネチャー4に加えて、APOBEC酵素の活性化に由来するシグネチャー2/13が、肝臓がんではシグネチャー16が喫煙者で有意に増加していました。詳細な分子機構は不明ですが、これらのがんにおいては、喫煙に伴い臓器特異的にある種の変異パターンによる突然変異が増加することが、喫煙リスクの原因の一部となっていることが推測されました。
|
組織型 |
Signature 4の 有無 |
喫煙と相関して有意に増加した変異パターン |
タイプの分類 |
|---|---|---|---|
|
肺がん(小細胞がん) |
◯ |
- |
※ |
|
肺がん(扁平上皮がん) |
◯ |
4, 5 |
タイプ1 |
|
肺がん(腺がん) |
◯ |
2, 4, 5, 13 |
タイプ1 |
|
喉頭がん |
◯ |
4, 5 |
タイプ1 |
|
咽頭がん |
◯ |
5 |
タイプ2 |
|
口腔がん |
◯ |
5 |
タイプ2 |
|
食道がん(扁平上皮がん) |
◯ |
5 |
タイプ2 |
|
食道がん(腺がん) |
◯ |
- |
タイプ3 |
|
膀胱がん |
☓ |
5 |
タイプ2 |
|
肝臓がん |
◯ |
4, 5, 16 |
タイプ1 |
|
胃がん |
☓ |
N/A |
※ |
|
急性白血病 |
☓ |
N/A |
※ |
|
卵巣がん |
☓ |
N/A |
※ |
|
子宮頸部がん |
☓ |
- |
タイプ3 |
|
腎臓がん |
☓ |
5 |
タイプ2 |
|
膵がん |
☓ |
- |
タイプ3 |
|
大腸がん |
☓ |
N/A |
※ |
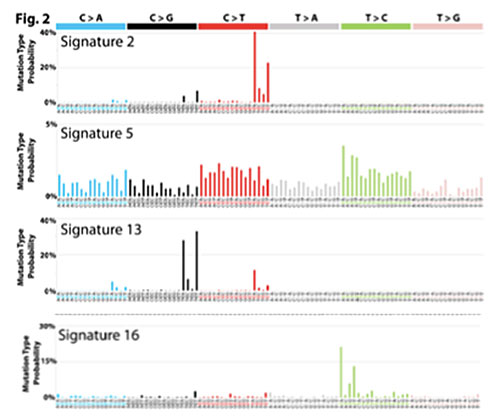
図2 喫煙と関連して増加していたその他(シグネチャー2, 5, 13, 16)の変異パターン
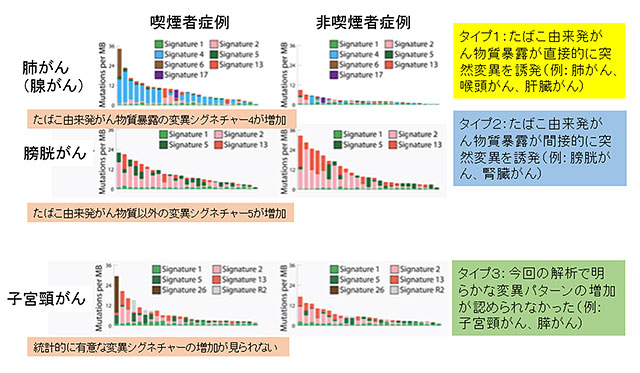
図3 喫煙によって発がんリスクが上昇するがんの3つのタイプ
今後の期待
大規模ながんゲノムデータを用いた解析によって、喫煙と関連するがんでは、①喫煙歴と相関して明らかに突然変異数の増加が認められること、②その原因として、たばこに含まれる発がん物質の直接暴露によって突然変異が誘発される場合から、より一般的な突然変異誘発プロセスの活性化まで、臓器によって複雑で特徴的な分子機構が存在すること、が明らかとなりました。本研究によって、がんの発症において喫煙が全ゲノムレベルで突然変異を誘発していることが再確認され、がんの予防における禁煙の重要性が強調されるとともに、今後喫煙がどのように間接的な突然変異誘発機構を活性化するのかに関する分子機構の詳細な解明によって、喫煙関連がんの予防や治療が進むことが期待されます。
また本研究で用いられた解析手法によって、他の発がんリスク要因(肥満、食事等の生活習慣)についても、その背景にある分子実体の解明からがん予防戦略を加速する鍵の解明が期待されます。
共同研究グループ
- 国立がん研究センター 研究所 がんゲノミクス研究分野
- 分野長 柴田龍弘(しばた たつひろ)、ユニット長 十時泰(ととき やすし)
- 理化学研究所 統合生命医科学研究センター ゲノムシーケンス解析研究チーム
- チームリーダー 中川英刀(なかがわ ひでわき)、客員研究員 藤本明洋(ふじもと あきひろ)
- ロスアラモス国立研究所
- Ludmil B. Alexandrov
- サンガー研究所
- Iñigo Martincorena, Serena Nik-Zainal, Peter J. Campbell, Michael R. Stratton
- Korea Advanced Institute of Science and Technology
- Young Seok Ju
- The Francis Crick Institute
- Peter Van Loo
- Medical Research Council (MRC)–Public Health England (PHE)
- Paolo Vineis
- King’s College London
- David H. Phillips
論文情報
- 雑誌名:
- Science
- タイトル:
- Mutational signatures associated with tobacco smoking in human cancer.
- 著者名:
- Ludmil B. Alexandrov, Young Seok Ju, Kerstin Haase, Peter Van Loo, Iñigo Martincorena, Serena Nik-Zainal, Yasushi Totoki, Akihiro Fujimoto, Hidewaki Nakagawa, Tatsuhiro Shibata, Peter J. Campbell, Paolo Vineis, David H. Phillips, Michael R. Stratton
- DOI:
- 10.1126/science.aag0299
研究費
国立研究開発法人日本医療研究開発機構(AMED)革新的がん医療実用化研究事業「国際連携を基盤とした日本人難治固形がんゲノム統合解析による新たな治療標的の同定と予防戦略への展開研究」
国立研究開発法人国立がん研究センターがん研究開発費(26-A-6)
用語解説
- *1 変異パターン(mutation signature)
- 突然変異は4種類の塩基がそれぞれ別の塩基に置換されるため全部で12種類あるが、DNAはA:T、C:Gの相補的な2本鎖であるため(例えばC>AとG>Tを区別できない)6種類に分類される。更にその前後の塩基配列情報を加えることで、4x6x4=96通りに分類できる。これまでの研究から、がんを起こす原因によってこの96種類の突然変異がそれぞれ特徴的な組み合わせで起こることがわかり、それらの組み合わせは変異パターン(Mutation signature)と呼ばれる。すでにヒトのがんにおいては、30種類以上の変異パターンがあることが知られており、そのうち半数は既知の発がん要因と密接に関連することから、それらが原因となって誘発されたものと考えられており、一部は実験的にも因果関係が証明されている。
- *2 国際がんゲノムコンソーシアム(ICGC)
- ICGCはInternational Cancer Genome Consortiumの略。がんのゲノム異常の包括的なカタログを作成するという目的を達成するため、2008年に発足した国際連携研究組織。ICGCの各メンバーは、データ収集・解析に関するICGCの共通基準のもと、1種類のがんについて500症例を解析し、ICGCのデータベースに登録して世界中に公開する。2016年8月現在、ヨーロッパ、南北アメリカ、アジア、オーストラリアの17カ国が参画し、89種のがんについての大規模ゲノム研究プロジェクトが進められている。これまで、16.000例以上のがんのゲノム情報がICGCのポータルサイトで公開され、世界中のがん研究に活用されている。日本からは、国立がん研究センター、理化学研究所、東京大学が中心となって参画している。ICGC ホームページ:https://icgc.org/
- *3次世代シークエンス
- ヒトゲノムの全配列約30億塩基を1,000米ドル以下のコストで解読すべく、欧米の政府や企業が技術開発を行った結果、より高速高精度の性能を持つシーケンサーが開発された。従来の方法に比べ、超大量のDNAシーケンス反応を並列して行うことができる。現在最新の機器では、6日間で約1兆個(ヒトゲノム10人分)の塩基配列を解読できる。
お問い合わせ先
発表者 ※研究内容については発表者にお問い合わせください
国立がん研究センター 研究所 がんゲノミクス研究分野
分野長 柴田 龍弘(しばた たつひろ)
(東京大学医科学研究所 ヒトゲノム解析センター ゲノム医科学分野 教授)
TEL:03-3542-2511(内線3123)、FAX:03-3547-5137
E-mail:tashibat“AT”ncc.go.jp
理化学研究所 統合生命医科学研究センター
ゲノムシーケンス解析研究チーム
チームリーダー 中川 英刀(なかがわ ひでわき)
TEL:03-5449-5786 FAX:03-5449-5785
E-mail:hidewaki“AT”ims.tokyo-u.ac.jp
機関窓口
国立がん研究センター 企画戦略局 広報企画室
TEL:03-3542-2511(代表) FAX:03-3542-2545
E-mail:ncc-admin“AT”ncc.go.jp
理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
E-mail:ex-press“AT”riken.jp
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 がん研究課
〒100-0004 東京都千代田区大手町一丁目7番1号
TEL:03-6870-2221
E-mail:cancer“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 平成28年11月4日
最終更新日 平成28年11月4日


