プレスリリース 患者さん由来iPS細胞を用いた化合物スクリーニングにより、 筋萎縮性側索硬化症の治療標的分子経路を同定
プレスリリース
国立研究開発法人日本医療研究開発機構(AMED)
ポイント
- 筋萎縮性側索硬化症(ALS)(注1)は、運動ニューロンが変性して筋萎縮と筋力低下を来す疾患で、そのメカニズムは詳しく知られておらず、十分な治療法がない。
- SOD1遺伝子に変異を有する家族性ALS患者さん由来iPS細胞から作製した運動ニューロンを用いて、化合物スクリーニングを行い、ALS運動ニューロンの細胞死を抑える既存薬と、ALSの病態に関与する分子経路を同定した。
- 同定した既存薬は、オートファジー(注2)を促進することにより、異常タンパク質蓄積と細胞死を抑制した。
- 同定した既存薬は、SOD1変異を有するALSマウスや、他の変異を有する家族性ALS患者さんあるいは孤発性ALS患者さん由来運動ニューロンでも有効性を認めた。
1.要旨
今村恵子特定拠点助教および井上治久教授(京都大学CiRA増殖分化機構研究部門)らの研究グループは、国内外の研究グループらとともに、ALS患者さん由来iPS細胞を用いて治療薬探索のための薬剤スクリーニングを行い、ALSの治療標的となる分子経路とALS運動ニューロンの細胞死を抑える既存薬を同定しました。
ALSは、運動ニューロンが進行性に変性して筋萎縮と筋力低下を来す疾患で、そのメカニズムは詳しく知られておらず、まだ十分な治療法がありません。ALSはほとんどの場合が孤発性ですが、家族性では、遺伝要因としてSOD1遺伝子やTDP-43遺伝子の傷(変異)、C9orf72遺伝子内のくり返し配列の伸長などが知られています。
本研究では、SOD1遺伝子に変異を有する家族性ALS患者さんから作製したiPS細胞、遺伝子変異を修復したiPS細胞と健康な方から作製したiPS細胞(対照群)に、Lhx3、Ngn2、Isl1という3つの転写因子(注3)を加えて運動ニューロンへと変化(分化)させました。すると、患者さん由来運動ニューロンでは異常に折りたたまれたタンパク質が蓄積し、細胞死を起こしやすいことが分かりました。そこで、ALS患者さんの運動ニューロンの細胞死を抑制する化合物を見つけるため、SOD1変異を有する家族性ALS患者さん由来運動ニューロンを用いて、細胞死を標的としたスクリーニング系を構築しました。既存薬を含む1,416個の化合物について、運動ニューロンの細胞死を抑えるかどうかのスクリーニングを行ったところ、27個の薬が細胞死を強く抑えました。また、その約半数がSrc/c-Ablというタンパク質の分子経路に関連していることが分かりました。さらに、細胞死を強く抑える化合物の中で、慢性骨髄性白血病の治療薬として用いられているボスチニブという既存薬は、オートファジーといわれる不要なタンパク質を分解する働きを促進し、ALSの病態の一つである異常に折りたたまれたタンパク質を減らすことが分かりました。ボスチニブを、SOD1変異を有するALSマウスに投与したところ、有効性を示しました。さらに、TDP-43遺伝子変異あるいはC9orf72リピート伸長を有する家族性ALS患者さん由来iPS細胞から作製した運動ニューロンや、孤発性ALS患者さん由来iPS細胞から作製した運動ニューロンの一部でもボスチニブが細胞死を抑制することが分かりました。本研究は、今後のALSの治療薬開発研究に貢献するものと期待されます。
この研究成果は2017年5月24日(米国時間)に米国科学誌「Science Translational Medicine」でオンライン公開されます。
2.研究の背景
3.研究成果
1) 家族性ALS患者さんiPS細胞由来運動ニューロンの細胞死を標的とした化合物スクリーニング系を構築した
まず、グループは、SOD1遺伝子に変異をもつ家族性ALS患者さんの皮膚細胞からiPS細胞を作製しました。その際、CRISPR-Cas9というゲノム編集技術を用いて、患者さんの遺伝子変異を修復したiPS細胞も作製しました。その後、iPS細胞にLhx3、Ngn2、Isl1という3つの転写因子を加えて、運動ニューロンへと分化させました。すると、家族性ALS患者さん由来運動ニューロンでは、折りたたみ異常を示すタンパク質が蓄積しており、健康な方由来運動ニューロンや変異を修復した運動ニューロンよりも、細胞死を来しやすいことが分かりました。そこで、運動ニューロンの細胞死を抑制する薬を見つけるため、SOD1変異を有する家族性ALS患者さんiPS細胞由来運動ニューロンを用いて、多くの化合物の効果を調べることができるスクリーニング系を構築しました。既存薬を含む1,416個の化合物について、運動ニューロンの細胞死を抑えるかどうかのスクリーニングを行ったところ、27個の化合物が細胞死を強く抑えることが分かりました。
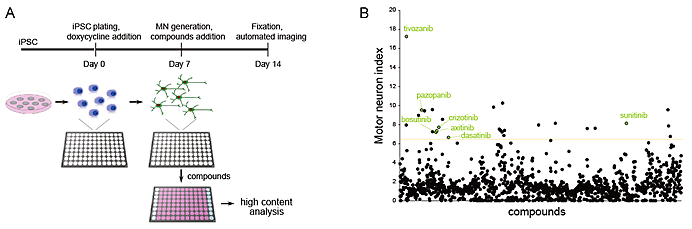 図1.ALS患者さんiPS細胞由来運動ニューロンを用いた化合物スクリーニング
図1.ALS患者さんiPS細胞由来運動ニューロンを用いた化合物スクリーニング
- A. 化合物スクリーニングのプロトコール。iPS細胞から運動ニューロンへと分化した7日目に、化合物を運動ニューロンに投与し、14日目にその効果を解析した。
- B. 1,416個の化合物のスクリーニング結果。1つの点が、1種類の化合物を示す。縦軸は運動ニューロンの生存率を示す。
2) 化合物スクリーニングの結果から、ALS運動ニューロンの細胞死に関連する分子経路を明らかにした
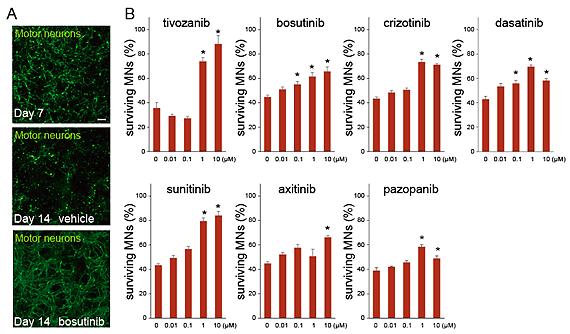 図2.ALS運動ニューロンの細胞死を抑える既存薬の効果
図2.ALS運動ニューロンの細胞死を抑える既存薬の効果
- A. 運動ニューロンの染色像(スケールバー;100μm)
- 上:iPS細胞から分化7日目のALS運動ニューロン
- 中:化合物を投与しない場合のALS運動ニューロン(14日目)
- 下:ボスチニブを投与した場合のALS運動ニューロン(14日目)
- B. 細胞死を抑える既存薬の効果
- 縦軸は運動ニューロンの生存率、横軸は既存薬の投与量を示す。
3) ボスチニブはオートファジーを促進し、異常タンパク質の蓄積と細胞死を抑制した
4) ボスチニブはALSマウスの病気の発症を遅延させ、生存期間を延長させた
さらに、SOD1変異を有するALSマウスにおけるボスチニブの効果を調べました。このマウスは、SOD1変異を持ち、ALSと同様に進行性の筋力低下を来して死亡するマウスです。このマウスにボスチニブを投与すると、ALSの発症を遅らせ、生存期間を延長することが分かりました。また、ALSマウス脊髄中の折りたたみ異常を呈するタンパク質の量を減少させました。
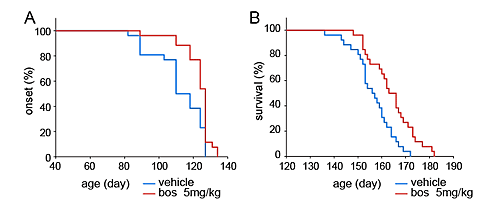
図3.ALSマウスにおけるボスチニブの効果
- A. ボスチニブはALSマウスの発症を遅らせた。
- 縦軸はマウスのALS発症率、横軸は日齢を示す。赤線は、ボスチニブを投与したALSマウスの発症率、青線は投与しなかったマウスの発症率の推移を示している。
- B. ボスチニブはALSマウスの生存期間を延長させた。
- 縦軸はマウスの生存率、横軸は日齢を示す。赤線は、ボスチニブを投与したALSマウスの生存率、青線は投与しなかったマウスの生存率の推移を示している。
5) ボスチニブは他の家族性ALS運動ニューロンや孤発性ALS運動ニューロンの細胞死にも有効性を示した
最後に、SOD1変異を有する家族性ALS患者さん以外のALS患者さん由来iPS細胞から作製した運動ニューロンにおけるボスチニブの効果を調べました。TDP-43遺伝子変異やC9orf72リピート伸長をそれぞれ有する家族性ALS患者さん由来運動ニューロンや、孤発性ALS患者さん由来運動ニューロンでもボスチニブが細胞死を抑制することが分かりました。
4.まとめ
ALS患者さん由来iPS細胞を用いた化合物スクリーニングを行うことにより、ALSに関連する分子経路とALS運動ニューロンの細胞死を抑える既存薬を同定することに成功しました。この既存薬は、ALSマウスでも有効であることが分かりました。しかし、すぐにALS患者さんの治療に使用できるわけではありません。今後、ALSの治療へと応用するためには、生体内での薬の有効濃度や髄液への移行性、安全性などを詳細に調べる必要があります。
本研究は、iPS細胞を用いた化合物スクリーニングがALSの治療薬開発に有用であることを示し、また同定した分子経路や有効性を示した化合物は、今後のALSの治療開発研究の進展に貢献するものと期待されます。
5.論文名と著者
- 論文名
- “The Src/c-Abl pathway is a potential therapeutic target in amyotrophic lateral sclerosis”
- ジャーナル名
- Science Translational Medicine
- 著者
- Keiko Imamura1, Yuishin Izumi2, Akira Watanabe1, Kayoko Tsukita1, Knut Woltjen1,3, Takuya Yamamoto1,4, Akitsu Hotta1,4,5, Takayuki Kondo1, Shiho Kitaoka1, Akira Ohta1, Akito Tanaka1, Dai Watanabe6, Mitsuya Morita7, Hiroshi Takuma8, Akira Tamaoka8, Tilo Kunath9, Selina Wray10, Hirokazu Furuya11, Takumi Era12, Kouki Makioka13, Koichi Okamoto14, Takao Fujisawa15, Hideki Nishitoh16, Kengo Homma15, Hidenori Ichijo15, Jean-Pierre Julien17, Nanako Obata18, Masato Hosokawa18, Haruhiko Akiyama18, Satoshi Kaneko19, Takashi Ayaki20, Hidefumi Ito21, Ryuji Kaji4, Ryosuke Takahashi20, Shinya Yamanaka1,22, Haruhisa Inoue1
- 著者の所属機関
-
- 京都大学iPS細胞研究所(CiRA)
- 徳島大学医学部
- 京都大学白眉センター
- 京都大学物質ー細胞統合システム拠点
- PRESTO, JST
- 京都大学医学研究科
- 自治医科大学
- 筑波大学
- エジンバラ大学
- UCL institute of Neurology
- 高知大学
- 熊本大学
- 群馬大学
- 老年病研究所附属病院
- 東京大学
- 宮崎大学
- ラヴァル大学
- 東京都医学総合研究所
- 関西医科大学神経内科
- 京都大学医学部神経内科
- 和歌山医科大学神経内科
- グラッドストーン研究所
6.本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- AMED 再生医療実用化研究事業
-
AMED 再生医療実現拠点ネットワークプログラム(疾患特異的iPS細胞を活用した難病研究)
- AMED 再生医療実現拠点ネットワークプログラム(iPS細胞研究中核拠点)
- 公益財団法人 持田記念医学薬学振興財団
- 公益財団法人 第一三共生命科学研究振興財団
- 日本学術振興会・文部科学省
- iPS細胞研究基金
- Parkinson’s UK
7.用語説明
- (注1)筋萎縮性側索硬化症(ALS)
- 運動ニューロンが選択的に変性・消失していく原因不明の疾患。筋萎縮と筋力低下が主な症状で、進行すると上肢の機能障害、歩行障害、嚥下障害、呼吸障害などを生じる。病気を起こすメカニズムは詳しく知られておらず、まだ十分な治療法ない。全国で約9,200人の患者さんがいる。約5%が家族性で、そのうちの約20%にSOD1遺伝子変異を伴う。その他、TDP-43遺伝子変異やC9orf72遺伝子内のくり返し配列の伸長などの遺伝要因が知られている。
- (注2)オートファジー
- 細胞自身が、細胞内のタンパク質を分解するしくみのひとつ。自食ともいわれる。
- (注3)転写因子
- タンパク質合成は、DNA上の遺伝子を鋳型としてメッセンジャーRNA(mRNA)が転写され、このmRNAが核外のリボソーム上で翻訳される過程で成り立っている。転写因子は、転写開始に関わるタンパク質因子で、DNAに結合して働くものや因子間の相互作用によって機能するものがある。
お問い合わせ先
本件担当
京都大学iPS細胞研究所(CiRA)
研究支援部門 国際広報室
中内
TEL:075-366-7005 FAX:075-366-7185
E-mail:media“AT”cira.kyoto-u.ac.jp
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 再生医療研究課
〒100-0004 東京都千代田区大手町一丁目7番1号
TEL:03-6870-2220 FAX:03-6870-2242
E-mail:saisei“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成29年5月25日
最終更新日 平成29年5月25日


