アルツハイマー病病因物質を低減させる既存薬カクテルの同定―患者由来iPS細胞を用いた化合物スクリーニングとin vitroトライアル―
プレスリリース
京都大学iPS細胞研究所(CiRA)
国立研究開発法人日本医療研究開発機構
ポイント
- アルツハイマー病(AD)(注1)の病因物質と考えられている、アミロイドベータ(Aβ)(注2)を低減させる効果のある化合物を探索するため、患者さん由来iPS細胞から作製した高純度の大脳皮質神経細胞を用いたスクリーニング系を確立した。
- スクリーニングに続いて、効果のあった化合物群をケモインフォマティクス(注3)により分子構造式の類似性にもとづいて分類し、アミロイドベータを相乗的に低減させる効果がある3種類の既存薬の組合せ(カクテル)を同定した。
- 同定した既存薬カクテルの多人数のAD患者さんでの効果を推定するために、家族性および孤発性AD患者さんの細胞を用いたin vitroトライアル(注4)を実施し、有効性を確認した。
1.要旨
近藤孝之特定拠点助教および井上治久教授(京都大学CiRA増殖分化機構研究部門幹細胞医学分野・理化学研究所バイオリソースセンター創薬細胞基盤開発チーム)らの研究グループは、アルツハイマー病患者さん由来iPS細胞を用いた化合物スクリーニング系を構築し、アルツハイマー病の病因物質のひとつである、アミロイドベータ(Aβ)を減らす事ができる既存薬の組み合わせ(カクテル)を見出しました。Aβを標的とするアルツハイマー病の薬物治療においては、発症前から長期間の投薬が必要と考えられています。そこで、すでに市場で長期間の安全性に関する情報が整備されている既存薬のスクリーニングを行いました。スクリーニングの後、効果のあった化合物群をケモインフォマティクスにより分子構造式の類似性にもとづいて分類し、相乗的な組み合わせ(カクテル)を見出しました。同定した既存薬カクテルは、家族性アルツハイマー病及び孤発性アルツハイマー病の10余名の患者さんのiPS細胞から分化誘導した大脳皮質神経細胞においてAβの減少効果を示しました。このin vitroトライアルは、多人数の患者さんにおける効果や有効性の個人差の推測に有用であることがわかりました。
この研究成果は2017年11月21日正午(米国時間)に米国科学誌「Cell Reports」でオンライン公開されます。
2.研究の背景
アルツハイマー病(AD)は、認知症の中で最も多い疾患であり、遺伝子変異が原因で起こる家族性ADと、家族歴のない孤発性ADに大別されます。どちらの種類のADも、大脳皮質の神経細胞内にアミロイドベータ(Aβ)が蓄積することが病因のひとつであると考えられています。家族性ADの原因遺伝子であるアミロイドβ前駆体タンパク(APP)やプレセニリン1(PSEN1)に変異があると、Aβが増えることが知られています。一方で、アイスランドにおける全ゲノム解析コホート研究(注5)において、Aβを30~45%程度減らす効果があるAPP A673T変異はAD発症や認知機能低下に保護的に働くことがわかりました(Jonsson T et. al., Nature, 2012;488;96, Maloney J. et al., J Biol Chem., 2014;289;30990)。すなわち、Aβ量がADの発症に強く相関しており、Aβは重要なADの治療標的といえます。しかし、AD患者さんの脳内のAβ蓄積は、認知症症状が生じるよりも二十年ほど前から始まっていることが知られており(図1)、Aβを標的とする治療薬は数十年の間投与できる安全性が求められます。これまで、Aβの産生を行う酵素の作用を直接抑える化合物が数多く作製されましたが、いくつかの臨床試験においては副作用の発露によりその試験が中止されています。そのため未知の作用に対する慎重な配慮のもと臨床試験が進められています。
そこで本研究グループは、長期間の内服に関する安全性情報が整備されている既存薬の中からAβを低減させる化合物を見出すことにしました。患者さん由来のiPS細胞から迅速かつ大量に高純度の大脳皮質神経細胞を作製する技術を用いてスクリーニング系の構築研究に取り組みました。
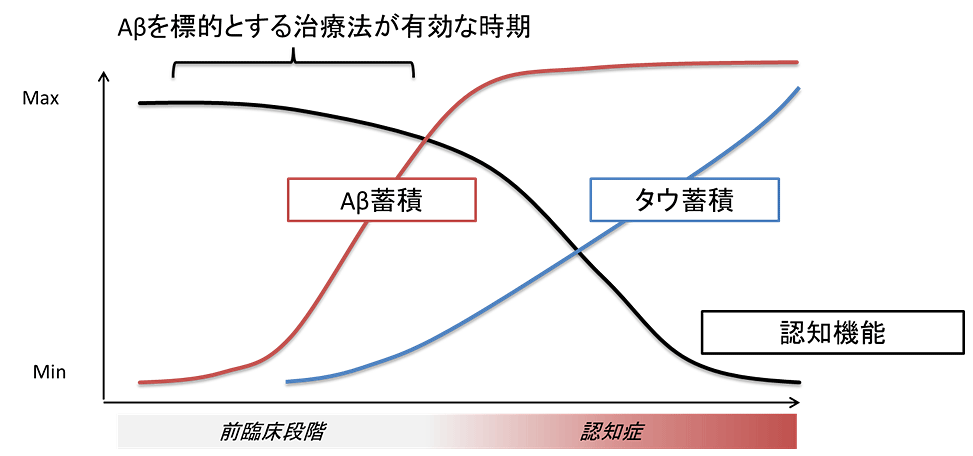
図1:アルツハイマー病の病態自然経過とAβを標的とする治療法が有効な時期(Jack CR, Lancet Neurol., 2010;9;119より改変)
3.研究結果
患者さん由来iPS細胞を用いて化合物スクリーニング系を構築
➀患者さん由来iPS細胞から高効率で大脳皮質神経細胞を作製する方法
ADの病理学的特徴を厳密に再現し、多くの化合物の効果を調べる化合物スクリーニングを行うためには、患者さん由来iPS細胞から迅速かつ大量に純度の高い大脳皮質神経細胞を作製することが必要です。本研究グループが用いた細胞株では、iPS細胞にNGN2遺伝子を発現させた後、8日後にほぼ100%の純度で大脳皮質神経細胞が得られています。
➁患者さん由来の大脳皮質神経細胞がアルツハイマー病の病態を再現
Aβには構成するアミノ酸の長さが異なるいくつかの種類があり、特に毒性が高い種類であるAβ42は、家族性ADの原因となるPSEN1遺伝子変異があると増加することが知られています。そこで、PSEN1遺伝子に変異がある家族性AD患者さんの皮膚線維芽細胞から樹立したiPS細胞を用いて、➀の方法により大脳皮質神経細胞を分化誘導しました。同時にPSEN1遺伝子の変異をゲノム編集技術(注6)により修復した細胞株と比較することで、PSEN1遺伝子変異がAβに与える影響を調べました。これより、PSEN1遺伝子変異が存在すると、培養上清中で測定されるAβ42の産生量が多いことがわかりました。さらに、同じ家族性AD患者さんの末梢血単核球細胞からiPS細胞を樹立して分化誘導した大脳皮質神経細胞は、線維芽細胞由来のiPS細胞を用いた場合と同様のAβ産生動態を示しました。これらのことから、本研究で構築したAβ評価系は、異なる体細胞由来の異なるiPS細胞株であっても、AD患者さんの表現型を反映することがわかりました。このAβ評価系は既存のAβ産生調製化合物にも濃度依存性に反応し、化合物スクリーニングに適応できることが確認されました。
アミロイドベータの蓄積を抑える既存薬の組合せの探索
次に、Aβの産生を抑制する既存薬の探索を行いました。スクリーニングには、長期間内服に関する安全性情報が整備されている1,258種類の既存薬で構成される化合物ライブラリを用いました。スクリーニングの結果、細胞毒性が低く、細胞培養上清中のAβ42量を低下させる化合物を選び出しました(図2)。
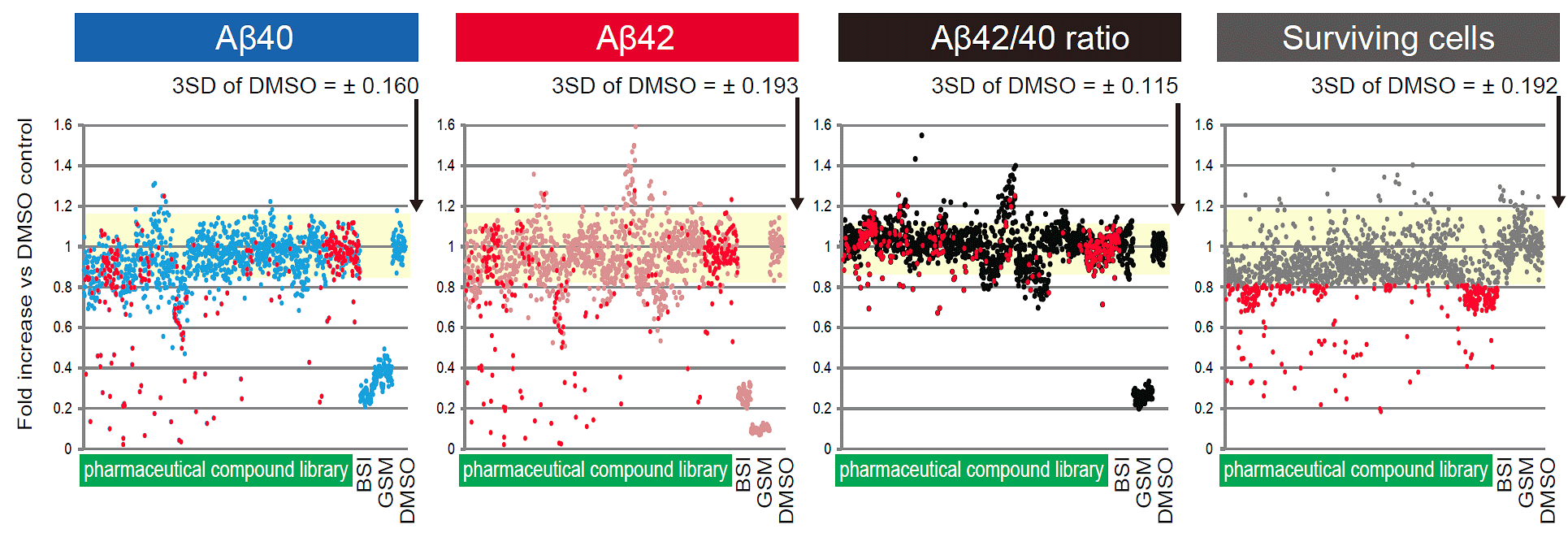
図2:培養上清中Aβの変動を指標としてスクリーニングを実施
横軸はライブラリの異なる化合物、および陽性コントロールのβ-セクレターゼ阻害薬(BSI)、γ-セクレターゼ調製薬(GSM)、陰性コントロールとして用いた化合物溶媒(DMSO)を示す。縦軸はDMSOのみを添加した際のAβ量を100%とした時の、相対変化率を示す。グラフは左からAβ40・Aβ42・Aβ42/40比率(数値が低いほど薬効が高い)、生細胞のプロット図(数値が低いほど毒性が強い)を示す。
一方で、見出した化合物のAβ低減効果は、既知のβ-あるいはγ-セクレターゼ阻害作用をもつ化合物と比べて弱いものでした。そこで、化合物を組み合わせることでAβ低減効果を増強することを目的として、Aβ低減効果のあった化合物を分子構造式の類似性にもとづいて10種類のグループに分類しました。それぞれのグループから用量依存性が明確で最もAβ低減効果が強い6種類の化合物、ブロモクリプチン・シロスタゾール・クロモリン・フルバスタチン・プロブコール・トピラマートを選び出しました。
次に、6種類の化合物の組み合わせることでAβの低減効果を最大化するために、2種あるいは3種の総当りで化合物を組合せ、それぞれのAβ産生動態に与える影響を比較しました。すると、ブロモクリプチン、クロモリン、トピラマートの3種類の組合せ(BCroT)において最もAβの低減効果が高まることがわかりました。さらにこのBCroTの組み合わせにおいても、用量依存性の効果が明確に見られました。
家族性ADおよび孤発性AD患者さんのiPS細胞でのBCroTの効果検証
BCroTが多様なADに対して効果があるのかを調べるため、スクリーニングに用いた患者さんに加えて、PSEN1遺伝子またはAPP遺伝子に変異のある家族性AD患者さん、孤発性AD患者さん、健常者由来のiPS細胞および家族性AD患者さん由来の細胞の遺伝子変異を修復したiPS細胞から作製した大脳神経細胞にBCroTを添加し、Aβの産生を抑える効果を検証しました。すると、個人差はあるものの、すべての患者さんの大脳神経細胞においてBCroTはAβ42および Aβ40の産生量を30%以上低下させることがわかりました(図3)。
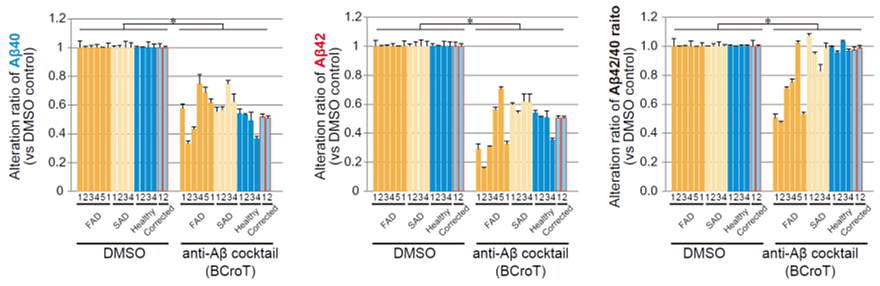
図3:BCroTをさまざまなアルツハイマー病患者さんの大脳神経細胞に添加したときのAβ40の相対量(左)、Aβ42の相対量(中央)、Aβ42/40比率の相対値(右)
FAD:家族性AD患者さん、SAD:孤発性AD患者さん、Healthy:健常者、Corrected:家族性AD患者さんの遺伝子変異を修復、DMSO:化合物溶媒であるDMSOのみを添加した陰性コントロール、既存薬カクテル(BCroT):BCroTを加えたときの結果。縦軸はDMSOを添加した際のAβ量を100%とした時の、相対変化率を示す(数値が低いほど薬効が高い)。
4.まとめ
5.論文名と著者
- 論文名
- iPSC-based compound screening and in vitro trials identify a synergistic anti-amyloid β combination for Alzheimer's disease
- ジャーナル名
- Cell Reports
- 著者
- Takayuki Kondo1,2, Keiko Imamura1,2, Misato Funayama1, Kayoko Tsukita1, Michiyo Miyake1,2, Akira Ohta1, Knut Woltjen1,3, Masato Nakagawa1, Takashi Asada4, Tetsuaki Arai4, Shinobu Kawakatsu5, Yuishin Izumi6, Ryuji Kaji6, Nobuhisa Iwata7,8, Haruhisa Inoue1,2*
*責任著者 - 著者の所属機関
-
- 京都大学iPS細胞研究所
- 理化学研究所バイオリソースセンター創薬細胞基盤開発チーム
- 京都大学白眉センター
- 筑波大学附属病院精神神経科
- 福島県立医科大学会津医療センター精神医学講座
- 徳島大学大学院医歯薬学研究部臨床神経科学(神経内科)
- 長崎大学大学院医歯薬学総合研究科ゲノム創薬学研究室
- 長崎大学大学院医歯薬学総合研究科認知症創薬研究ユニット
6.本研究への支援
本研究は、下記機関より資金その他の支援を受けて実施されました。
- 国立研究開発法人日本医療研究開発機構(AMED)再生医療実用化研究事業
- 国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム(iPS細胞研究中核拠点)
- 科研費若手研究(B)(17K16121)
7.用語説明
- (注1)アルツハイマー病(AD)
- ドイツの精神科医、アルツハイマー博士により1905年に報告された進行性の記憶障害を伴う認知症。中高年で発病し、徐々に進行して生活に支障をきたすようになり、最終的には意思疎通ができなくなる。その病理特徴としては、脳内に老人斑といわれるタンパク質の沈着が見られ、この老人斑の主成分がアミロイドベータ(注2)であることから、アミロイドベータの過剰な蓄積がアルツハイマー病の発症に深く関わっていると考えられてきた。我が国でも患者数は数百万人で、進行を止める治療法がない現状のままでは、今世紀半ばには世界で1億人に達するとされる。
- (注2)アミロイドベータ(Aβ)
- 家族性アルツハイマー病の原因遺伝子であるAPPがコードするアミロイドβ前駆体タンパクから、β-セクレターゼ・γ-セクレターゼなどの酵素切断の結果産生される。近年の大規模ヒト遺伝医学的研究から、Aβ産生が低下するとADの発症が抑制されることが示されている。
- (注3)ケモインフォマティクス
- 計算機と情報処理技術を化学領域の問題に適応し解決を目指す研究手法。本研究においては、スクリーニングで見出された化合物群とAβ産生を制御することが知られている化合物群の構造式を、計算機が処理しやすい線形表記に変換して一度に構造式の類似性検討を行い、化学構造が類似するクラスタに分類した。
- (注4)in vitroトライアル
- 様々なヒト(患者さんや健常者)を対象として新しい治療法の有効性を検討する臨床試験(トライアル)とはことなり、様々なヒト(患者さんや健常者)由来の細胞を用いてin vitro環境下(培養皿の中)で新しい治療法の薬効を検討するという研究手法。疾患関連遺伝子を過剰発現することでモデル化したがん細胞株や動物では評価することができない、ヒトの個性を反映した薬効評価を行うことが出来ると期待される。
- (注5)全ゲノム解析コホート研究
- 被験者のゲノムを解析し、特定の要因をもつ集団とそうでない集団について一定期間追跡調査を行い、疾患の発症率などを比較する研究。
- (注6)ゲノム編集技術
- 部位特異的にはたらくDNA切断酵素を用いて、目標とするゲノム領域を編集する技術。
お問い合わせ先
本研究成果に関するお問合せ先
京都大学iPS細胞研究所(CiRA)
研究支援組織 国際広報室
TEL:075-366-7005
FAX:075-366-7185
E-mail:cira-pr“AT”cira.kyoto-u.ac.jp
AMED事業に関するお問合せ
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 再生医療研究課
TEL:03-6870-2220
FAX:03-6870-2243
E-mail:saisei“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成29年11月22日
最終更新日 平成29年11月22日


