プレスリリース 記憶をつくる分子の働きにドレブリンが関与
プレスリリース
国立大学法人群馬大学
国立研究開発法人日本医療研究開発機構
趣旨・目的
私たちが物ごとを記憶する時、脳の中のシナプス(※1)と呼ばれる場所のかたちが変わります。このかたちの変化に働く分子として、カルシウムカルモジュリン依存性タンパク質キナーゼ(以下、CaMKII)とドレブリンという分子が知られていました。これまでは、この2つの分子は独立して働いていると考えられていましたが、今回の研究で、これらの2つの分子は密接に関係していることがわかりました。
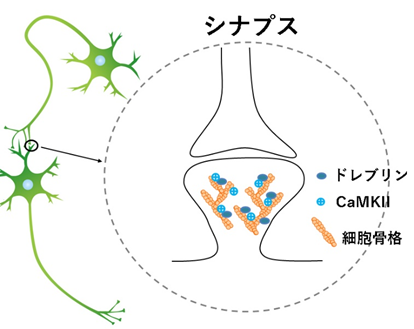
シナプスでは多くの分子が働いていますが、CaMKIIは最も詳しく研究されている分子の一つで、記憶形成に重要な働きを担っていると考えられています。私たちの研究グループは、ドレブリンがCaMKIIに結合し共同してシナプスで働いていることを発見しました。
この成果は、神経化学の国際雑誌「ジャーナル・オブ・ニューロケミストリー誌」に掲載されるのに先立ち、オンライン版にて日本時間の平成30年6月12日に公開されました。
概要
ドレブリンは群馬大学で1985年に発見された分子で、シナプスでの機能の他に、がんの転移やウィルス感染にも関わっているタンパク質です。酵母ツーハイブリッド法(※2)を用いて、ドレブリンと結合するタンパク質のスクリーニング(選別、振るい分け)を行ったところ、CaMKIIのβサブタイプ(※3)(以下、CaMKIIβ)が見つかりました。
ドレブリンもCaMKIIβもシナプスに豊富に存在する分子として知られています。人工的に神経細胞からドレブリンの量を減らすと、CaMKIIβがシナプスから少なくなりました。この反対の実験、つまり、CaMKIIβを減らす実験では、ドレブリンは影響を受けませんでした。このことから、ドレブリンがCaMKIIβの働きを調節していると考えられます。さらに詳細な検討の結果、ドレブリンはCaMKIIβが活発に働く前のスタンバイ状態の維持に働いていることが示唆されました。ドレブリンもCaMKIIβも細胞のかたちに関わる細胞骨格であるアクチン繊維に結合する分子として知られています。つまり、この3つの分子(ドレブリン/CaMKIIβ/アクチン繊維)は複合体を形成していると考えられます。シナプスが活動する時、細胞の外からカルシウム(※4)が入ってきますが、このときドレブリンとCaMKIIβとアクチン繊維は、一度離ればなれになります。その後、アクチン繊維が再構成されてシナプスのかたちが変わります。CaMKIIβはカルシウム濃度が上昇すると活性化しアクチン繊維から離れることから、CaMKIIβはこのドレブリン/CaMKIIβ/アクチン繊維複合体のカルシウムセンサーの役割を担っている点も示唆されました。
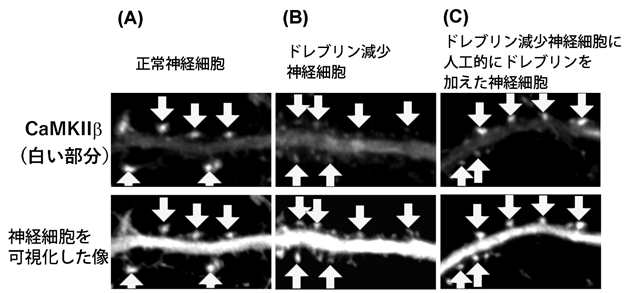
(A)正常な神経細胞では、CaMKIIβは、白い矢印の部分(シナプス後部)にあることが分かり ます。
(B)ドレブリンを減少させた神経細胞では、CaMKIIβは、白い矢印の部分(シナプス後部) から消失しました。
(C)ドレブリンを減少させた神経細胞に人工的にドレブリンを加えると、CaMKIIβは、白い 矢印の部分(シナプス後部)に戻りました。
社会的意義とこれからの展望
ドレブリンはアルツハイマー病で広範囲に減少するタンパク質として知られていますが、初期症状である軽度認知障害でも減少することがわかっています。今回の発見で、ドレブリンの減少がCaMKIIの働きを弱め、認知症の初期症状を引き起こしていることが示唆されました。このことから、ドレブリンの働きを強めたり、量を増やしたりする薬剤を開発することにより、認知症治療薬開発につながることが期待されます。
共同研究者
- 群馬大学 大学院医学系研究科 神経薬理学分野
- 助教 山崎 博幸 (やまざき ひろゆき)
- 教授 白尾 智明 (しらお ともあき)
- 大学院生 笹川 快生 (ささがわ よしお)
- 琉球大学 大学院医学研究科 生化学講座
- 教授 山本 秀幸 (やまもと ひでゆき)
- 東京大学 大学院医学系研究科 神経生化学分野
- 教授 尾藤 晴彦 (びとう はるひこ)
掲載論文
- 雑誌名:
- Journal of Neurochemistry
- Title:
- ”CaMKIIβ is localized in dendritic spines as both drebrin-dependent and drebrin-independent pools”
- Authors:
- Yamazaki H*, Sasagawa Y, Yamamoto H, Bito H, Shirao T.
(* 責任著者)
用語集
- (※1)シナプス:
- 神経細胞が他の神経細胞と情報伝達するための接合部。情報を出力する側をシナプス前部、情報を受け取る側をシナプス後部と呼ぶ。図では、上側の構造がシナプス前部、下側の構造がシナプス後部を示している。ドレブリンもCaMKIIもシナプス後部に存在する。
- (※2)酵母ツーハイブリッド法:
- タンパク質間相互作用やタンパク質-DNA間相互作用を調べる手法の一つ。
- (※3)βサブタイプ:
- CaMKIIは、CaMKIIα、CaMKIIβ、CaMKIIγ、CaMKIIδの4種類より構成され、脳では主にαサブタイプとβサブタイプが存在する。βサブタイプは、αサブタイプと複合体をつくる。
- (※4)カルシウム:
- 代表的なセカンドメッセンジャー。通常細胞内では非常に低濃度(~10-8M)に保たれているが、神経活動に伴って細胞内に流入し、CaMKII等のカルシウム依存的に働くタンパク質の活性化を引き起こす。
*本研究は、下記機関より支援を受けて実施しました。
- 文部科学省科学研究費補助金:基盤研究(A)、(C)及び挑戦的萌芽研究
- 国立研究開発法人日本医療研究開発機構(AMED)再生医療実用化研究事業:
平成29年度公募【ヒトiPS 分化誘導細胞を用いた医薬品の安全性評価法の開発研究】
課題名「創薬のためのインビトロ脳機能評価法の確立と標準化ヒト神経細胞の開発」(JP17bk0104077)
本件に関するお問い合わせ先
研究について
群馬大学 大学院医学系研究科 神経薬理学分野
助教 山崎 博幸(やまざき ひろゆき)
取材対応窓口
群馬大学 昭和地区事務部 総務課 広報係
TEL:027-220-7895
FAX:027-220-7720
AMED事業に関するお問合せ先
国立研究開発法人日本医療研究開発機構
戦略推進部 再生医療研究課
TEL:03-6870-2220
FAX:03-6870-2243
E-mail:saisei"AT"amed.go.jp
※E-mailは上記アドレス”AT”の部分を@に変えてください。
関連リンク
掲載日 平成30年6月14日
最終更新日 平成30年6月14日


