プレスリリース IgM五量体の真の姿と、疾患制御タンパク質AIMとの結合様式の発見
プレスリリース
東京大学
日本医療研究開発機構
発表者
宮﨑 徹(東京大学大学院医学系研究科 附属疾患生命工学センター 分子病態医科学 部門 教授)
新井 郷子(東京大学大学院医学系研究科 附属疾患生命工学センター 分子病態医科学 部門 准教授)
平本 絵美莉(東京大学大学院医学系研究科 博士課程2年生)
発表のポイント
- これまで正五角形をしていると信じられていたIgM五量体は、実は一ヵ所大きなギャップを持つ非対称で歪な五角形をしていることを、電子顕微鏡解析により明らかにした。
- 急性腎障害を始めとするさまざまな疾患を制御する血中タンパク質AIMは、そのギャップに嵌まり込むような形で、IgM五量体と安定的に結合し、不活性化していることを明らかにした。
- 本研究は、これまで50年以上教科書に記載されていたIgM五量体の構造を書き変える成果であると共に、IgMからAIMを解離させ活性化することによる、さまざまな疾患に対する新規かつ効率的な治療法の開発に貢献することが期待される。
発表概要
IgM抗体(注1)は、血中で5つの抗体単体が五量体を形成して存在する、ユニークな抗体である。過去50年間以上、IgM五量体は桜の花びらのような正五角形をしていると信じられており、実際そのように教科書に記載されてきた(図1)。IgM五量体は、多彩な免疫学的な働きと共に、一方で、さまざまな疾患を制御する血中タンパク質AIM(Apoptosis Inhibitor of Macrophage)(注2)の血中におけるキャリアーとして機能していることが知られている。AIMは腎疾患を始めとする多くの疾患を抑制する血中タンパク質であるが、正常時にはIgM五量体に結合し不活性化しており、疾患が発症するとAIMは解離し活性化して、疾患の治癒を促進する。しかし、これまでAIMがどのような様式でIgM五量体に結合しているのか分かっていなかった。
東京大学大学院医学系研究科の宮﨑徹教授らの研究グループは、IgM五量体は正五角形ではなく、一ヵ所大きなギャップを持った、歪な五角形をしており、そのギャップにAIMが嵌まり込むように結合していることを明らかにした(図1)。
本研究では、AMED創薬等先端技術支援基盤プラットフォーム(BINDS)の支援により、東京大学大学院医学系研究科の吉川雅英教授の協力を得て、負染色(注3)したAIMと結合・非結合状態のIgM五量体分子の2D構造を、最新の電子顕微鏡により観察することに成功した。その結果、IgM五量体の構造が、過去のどの研究結果よりも鮮明な像として捕らえられ、従来考えられていたものとは異なる真の構造と、AIMとの結合様式を明らかにすることができた。
本研究成果は、これまで50年以上免疫学の教科書に誤って記載されていたIgM五量体の構造を覆す成果である。現在、本研究グループを中心に、AIMをIgM五量体から解離させ活性化することにより、腎疾患を始めとするさまざまな疾患を対象とした創薬開発が進められているが、本研究によるAIMとIgM五量体との結合様式の解明は、そのような新規創薬開発に大きく貢献することが期待される。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)の研究開発領域「生体恒常性維持・変容・破綻機構のネットワーク的理解に基づく最適医療実現のための技術創出」(研究開発総括:永井 良三)(※)における研究課題「生体内の異物・不要物排除機構の解明とその制御による疾患治療」(研究代表者 宮崎 徹)、文部科学省科学研究費補助金基盤研究(S)の一環で行われた。
本研究成果は、2018年10月10日(米国東部夏時間)に「Science Advances」オンライン版で公開される。
(※)当該開発領域は、平成27年4月の日本医療研究開発機構の発足に伴い、国立研究開発法人科学技術振興機構(JST)より移管された。
発表内容
血中IgM抗体は、分子量の小さなJ鎖(注4)と共に五量体を形成して存在している。その形状については、1960年代の電子顕微鏡による観察結果を元に、シンメトリックな正五角形をしていると信じられてきており、その後の構造解析やモデリングに関しても、正五角形の形状をベースとして行われてきた(図1)。事実、免疫学の教科書にも、この50年来正五角形として記載されている。五量体となることにより、可変部領域(Fab領域)が5つセットになり、抗原への結合力が著しく上昇するという利点があると考えられている。因みに他の免疫グロブリンで五量体を形成するものはない。
IgM五量体は補体C1q(注5)と結合し活性化させるなど、外来の病原体に対する免疫学的な防御の最前線として機能している。また最近では、IgMは癌特異的抗原に対して結合し、さまざまな癌に対し抑制的な働きをすることも注目されている。一方で、自己免疫病の増悪にも関与していることが分かっており、身体にとって善・悪両方の効果を併せ持つ、ユニークな抗体である。この様な免疫学的な機能の一方、IgM五量体は血中において、本研究グループが以前発見した血中タンパク質AIM(文献1)と結合し、そのキャリアーになっていることが分かっている(文献2)。AIMは組織マクロファージの産生する血中タンパク質であり、これまで宮﨑教授のグループを中心に、急性腎障害、脂肪肝、肝細胞癌、肥満、真菌性腹膜炎、多発性硬化症などさまざまな疾患に対し抑制的な効果をもち、幅広い疾患に対する新規治療薬となる可能性を明らかにしている(文献3~7)。AIMはIgM五量体と結合することによって尿中排泄を回避し、結果として約5 mg/mLという高い血中濃度を維持しているが、その機能は不活性化している。一方で、AIMは疾患発症時にIgMから解離、活性化して、疾患の治癒を促進することが明らかになっている(文献8)。実際に、ネコに腎不全が多発するのは、ネコのAIMがIgM五量体から解離しないためであることも分かっている(文献9)。しかし、これまでAIMがどのような様式でIgMに結合しているのか分かっていなかった。
本研究グループは今回、AIMとIgM五量体の結合様式を検討するために、負染色したAIMが結合したIgM五量体の電子顕微鏡による構造解析を試みた。まずコントロールとして、AIMが結合していないマウスIgM五量体分子を解析したところ、驚いたことに、従来信じられていた正五角形ではなく、非対称の歪な五角形であり、約50度角の大きなギャップが一ヵ所存在することが明らかになった(図1)。この構造は、可変部領域の有り無しには無関係で、またヒトIgM五量体も同様の構造をしていた。次に、AIMが結合したIgM五量体を解析したところ、五量体の形状は変わらず、ギャップの中にAIMが嵌まり込むような形で結合していることが明らかになった(図1)。この結果はヒトでもマウスでも同様であった。
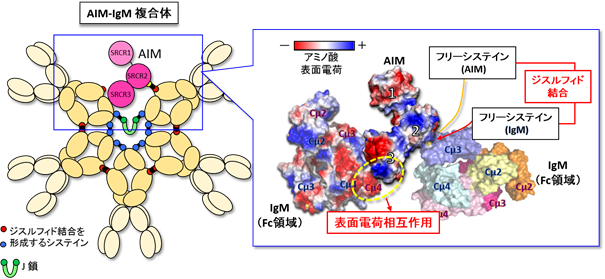
さらにいくつかの生化学的な実験を行い検討した結果、①AIMが持つ、システインを多く含む3つのドメインのうち、2番目のドメインに存在するフリーのシステイン残基が、IgM五量体にあるギャップの片側に存在するフリーのシステインとジスルフィド結合(注6)により結合していること、②AIMのC末端側の3番目のドメイン内に存在する正に荷電したアミノ酸のクラスターが、ギャップのもう片側に存在する負に荷電したアミノ酸クラスターと電荷による結合をしており、AIMにより、ギャップの両側のIgMがクロスブリッジされていることが明らかになった(図2)。
また、J鎖がないIgMは、六量体を作ることは以前から生化学的に知られていたが、今回J鎖無しのIgMが正六角形の六量体を形成していることも視覚化できた。そこにはAIMが結合できるギャップはなく、実際、生化学的な検討によっても、AIMはJ鎖のないIgM六量体には結合しないことが分かっている(文献2)。
本研究は、AMED-創薬等先端技術支援基盤プラットフォーム(BINDS)の支援により、東京大学大学院医学系研究科の吉川雅英教授の協力を得て、BINDSが所持する最新の電子顕微鏡と解析ソフトによって、初めて正確なIgM五量体の形状を明らかにすることが可能となった。そして、本研究成果は、これまで50年以上免疫学の教科書に誤って記載されていたIgM五量体の構造を正しく書き変える成果であった。また、本研究によるAIMとIgM五量体との結合様式の解明は、AIMをIgM五量体から解離させ活性化する新規創薬開発に対し有用な知見を提供し、創薬研究の進展に大きな貢献をすることが期待される。
文献
- Miyazaki, T. et al. J. Exp. Med. 189: 413-422 (1999).
- Arai, S. et al. Cell Rep. 3: 1187-1198 (2013).
- Arai, S. et al. Nat. Med. 22: 183-193 (2016).
- Kurokawa, J. et al. Cell Metab. 11: 479-492 (2010).
- Maehara, N., et al. Cell Rep. 9: 61-74 (2014).
- Tomita, T. et al. Sci. Rep. 25: 6450 (2017).
- Wang, C. et al. Cell. 163: 1413-1427 (2015).
- Miyazaki, T. et al. Cell Mol. Immunol. doi: 10.1038/cmi.2017.141 (2018).
- Sugisawa, R. et al. Sci. Rep. 6: 35251 (2016).
発表雑誌
- 雑誌名:
- Science Advances(10月10日オンライン版(米国東部夏時間))
- 論文タイトル:
- The IgM pentamer is an asymmetric pentagon with an open groove that binds the AIM protein
- 著者:
- Emiri Hiramoto, Akihisa Tsutsumi, Risa Suzuki, Shigeru Matsuoka, Satoko Arai*, Masahide Kikkawa, Toru Miyazaki* (すべて東京大学)
- DOI番号:
- 10.1126/sciadv.aau1199
用語解説
- (注1)IgM:
- 免疫グロブリンM。IgGやIgAなどと共に血中に存在する抗体の一種であり、抗体産生過程の最も初期に現れる抗体である。血中濃度は100~150mg/dL。
- (注2)AIM(Apoptosis Inhibitor of Macrophage):
- 当初マクロファージから分泌され、細胞のアポトーシス(細胞死)を抑制する分子として東京大学大学院医学系研究科の宮﨑徹教授が発見したもの。その後の研究で、作用する細胞の種類などの違いによりアポトーシス抑制以外にもさまざまな作用があることが明らかになった。
- (注3)負染色:
- カーボン支持膜などを張ったグリッド(メッシュ)に試料を吸着させ、酢酸ウランと鉛により染色し透過型電子顕微鏡で観察する技術で、精製したタンパク質あるいは複合体を高分解能で観察できる簡便な方法である。
- (注4)J鎖:
- 分子量15kDaの小さなポリペプチドで、IgMが五量体を形成する際に一分子結合し、五量体構造を安定させるといわれている。
- (注5)補体C1q:
- 補体は、生体が病原体を排除する際に抗体および貪食細胞を補助する免疫システム (補体系) を構成するタンパク質である。補体と呼ばれるタンパク群には複数のタンパクがあり、英語で補体を表す "complement" の頭文字をとってC1~C9で表される。これらのタンパク質群が連鎖的に活性化して免疫反応の一翼を担うが、代表的な活性化経路である古典的経路はC1qがIgM五量体に結合することから開始する。
- (注6)ジスルフィド結合:
- システインなど、水素化された硫黄を末端に持つ有機化合物(チオールという)同士で得られる共有結合。
添付資料
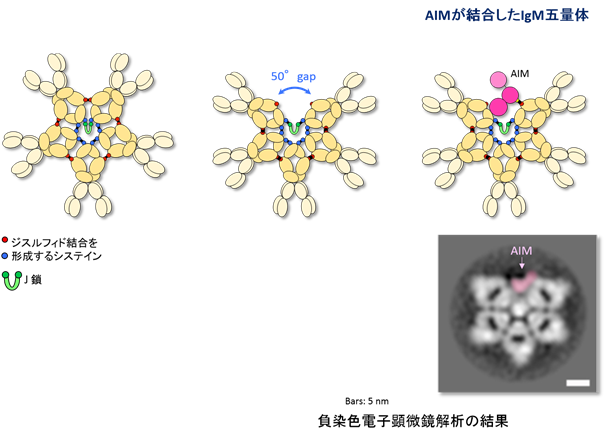
図1:IgM五量体の従来のモデルと、今回の研究成果による真の形状、およびAIMとの結合様式。
問い合わせ先
研究に関するお問い合わせ
東京大学大学院医学系研究科 附属疾患生命工学センター 分子病態医科学部門
教授 宮﨑 徹 (みやざき とおる)
TEL:03-5841-1436
FAX:03-5841-1438
E-mail:tm[at]m.u-tokyo.ac.jp
報道に関するお問い合わせ
東京大学大学院医学系研究科 総務係
TEL:03-5841-3304
Email:ishomu[at]m.u-tokyo.ac.jp
事業に関するお問い合わせ
国立研究開発法人 日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
TEL:03-6870-2224
FAX:03-6870-2246
E-mail:kenkyuk-ask[at]amed.go.jp
※E-mailは上記アドレス[at]の部分を@に変えてください。
関連リンク
掲載日 平成30年10月11日
最終更新日 平成30年10月11日


