プレスリリース 前立腺がんの「ゲノム医療」に貢献―日本人での原因遺伝子・発症リスク・臨床的特徴の大規模解析―
プレスリリース
理化学研究所
東京大学医科学研究所
栃木県立がんセンター
国立がん研究センター
日本医療研究開発機構
理化学研究所(理研)生命医科学研究センター基盤技術開発研究チームの桃沢幸秀チームリーダー、東京大学医科学研究所の村上善則教授、栃木県立がんセンターゲノムセンターの菅野康吉ゲノムセンター長、国立がん研究センターの吉田輝彦遺伝子診療部門長らの国際共同研究グループ※は、世界最大規模となる約2万人のDNAを解析して、日本人遺伝性前立腺がんの原因遺伝子・発症リスク・臨床的特徴について明らかにしました。
本研究成果は、日本人の前立腺がん患者一人一人に合った治療を行う「ゲノム医療」に貢献すると期待できます。
前立腺がんは日本人男性で4番目に患者数の多いがんであり、乳がんなどと同様に、そのうち数%程度の患者は一つの病的バリアント[1](個人間での1カ所のゲノム配列の違い)が発症の原因になると考えられています。しかし、前立腺がんは乳がんと異なり大規模なデータがほとんどなく、ゲノム情報を用いた医療の妨げになっていました。
今回、国際共同研究グループは、前立腺がんの原因と考えられる8個の遺伝子について、バイオバンク・ジャパン[2]により収集された前立腺がん患者7,636人および対照群12,366人のDNAを、独自に開発したゲノム解析手法を用いて解析しました。その結果、136個の病的バリアントを同定し、病的バリアント保有者は患者の2.9%であること、BRCA2、HOXB13、ATMの3遺伝子が発症に関わっていること、病的バリアント保有者の臨床的特徴などを明らかにしました。今後、これらのデータは国内外の公的データベースに登録、活用される予定です。
本研究は、米国の科学雑誌『Journal of the National Cancer Institute』のオンライン版(6月19日付け、日本時間6月20日)に掲載されました。
図 前立腺がんのゲノム医療
- ※国際共同研究グループ
- 理化学研究所
- 生命医科学研究センター
- 基盤技術開発研究チーム
- チームリーダー 桃沢 幸秀(ももざわ ゆきひで)
- 基礎科学特別研究員(研究当時)劉 暁渓(りゅう ぎょうけい)
- 技師 岩﨑 雄介(いわさき ゆうすけ)
- 統計解析研究チーム(研究当時)
- チームリーダー(研究当時) 鎌谷 洋一郎(かまたに よういちろう)
- ゲノム解析応用研究チーム
- 客員主管研究員 高橋 篤(たかはし あつし)(国立循環器病研究センター研究所 病態ゲノム医学部 部長)
- がんゲノム研究チーム
- 中川 英刀(なかがわ ひでわき)
- 統合生命医科学研究センター(研究当時)
- 副センター長(研究当時) 久保 充明(くぼ みちあき)
- Division of Genetics and Population Health, QIMR Berghofer Medical Research Institute(オーストラリア・ブリスベン)
-
- グループリーダー アマンダ・B・スパードル(Amanda B. Spurdle)
- 東京大学 医科学研究所
-
- 教授 村上 善則 (むらかみ よしのり)
- 東京大学大学院 新領域創成科学研究科 クリニカルシークエンス分野
-
- 教授 松田 浩一(まつだ こういち)
- 栃木県立がんセンター ゲノムセンター がん予防・遺伝カウンセリング科
-
- ゲノムセンター長 菅野 康吉(すがの こうきち)(国立がん研究センター中央病院 遺伝子診療部門・非常勤医員)
- 国立がん研究センター 中央病院 遺伝子診療部門
-
- 部門長 吉田 輝彦(よしだ てるひこ)
- 医員 平田 真(ひらた まこと)
研究支援
本研究は、日本医療研究開発機構(AMED)のオーダーメイド医療の実現プログラム「疾患関連遺伝子等の探索を効率化するための遺伝子多型情報の高度化(研究開発代表者:久保 充明)」の支援のもと行われました。
背景
前立腺がんは、世界で2番目に、日本人男性では4番目に患者数の多いがんであり、この20年間で患者数が急激に増加しています注1)。そして、多くのがんの中で、前立腺がんは遺伝性が強いがんとして知られています。その原因として、1.これまでゲノムワイド関連解析(GWAS)[3]により明らかにされてきた、疾患発症に及ぼす影響は小さいものの頻度が高い「一塩基多型(SNP)[4]」、そして2.頻度は非常に低いものの疾患発症リスクを大きく上げる「病的バリアント」の寄与が挙げられます。前立腺がんの原因遺伝子としては、乳がんの原因遺伝子としても知られるBRCA1、BRCA2を含め、8種類ほどが報告されています注2)。
前立腺患者がBRCA1やBRCA2に病的バリアントを持つ場合には、乳がんの場合と同様、PARP阻害剤[5]などの薬が効果的であることが知られています注3)。そのため、ある前立腺がん患者がこれらの病的バリアントを持つことが、遺伝子検査によって明らかになれば、乳がんと同じようにPARP阻害剤による治療効果が期待されます。さらに、同じ遺伝子が寄与する他のがんの早期発見、近親者に対する遺伝子検査も利用した発症予防が期待されます。
このような「ゲノム医療」を行うには、遺伝子検査結果の解釈、病的バリアント保有者の発症リスク、臨床的特徴についての大規模なデータが不可欠です。桃沢チームリーダーらは2018年に、日本人の遺伝性乳がんの病的バリアントデータベースを構築し、ゲノム医療に貢献しました注4)。
しかし、前立腺がんは乳がんと異なり、このようなデータが世界的に不足しており、ゲノム情報を用いた診療のガイドラインもありません。そこで、前立腺がんについて、原因遺伝子・疾患発症リスク・臨床情報の関係を大規模なサンプルで明らかにすることが、前立腺がんのゲノム医療につながると考え、研究を開始しました。
研究手法と成果
国際共同研究グループは、バイオバンク・ジャパンによって収集された前立腺がん患者(疾患群)7,636人および対照群12,366人のDNAを、理研が独自に開発したゲノム解析手法注5)を用いて、前立腺がんの原因として知られる8遺伝子について解析した結果、1,456個の遺伝子バリアント[1]を同定しました。
同定された遺伝子バリアントを国際的データベースClinVar注6)で確認したところ、登録されていたのは670個(46.0%)だけでした。また、そのうち58個は病的バリアント、216個は病的バリアントではない遺伝子バリアント、残りの396個は判定が不能でした。そこで、BRCA1、BRCA2遺伝子の病的バリアントを判定する国際コンソーシアムENIGMAのアマンダ・スパードルグループリーダーとともに、米国臨床遺伝・ゲノム学会(ACMG)が作成したガイドラインを使用して、1,456個の遺伝子バリアントについて、一つ一つ病的バリアントか否かを調べました。その結果、最終的にClinVarの結果と合わせて、今回同定した遺伝子バリアント1,456個中136個(9.3%)が病的バリアントであると判定しました。
次に、遺伝子ごとに病的バリアントのアミノ酸の位置とその頻度を確認するために、ロリプロット[6]を作成しました。その結果、多く(78.8%)の病的バリアントは7,636人の患者群の中で1人しか持っておらず、極めて頻度が低いことが分かりました。一方、10人以上で共有する頻度が高い病的バリアントが、ATM遺伝子では1個、BRCA2遺伝子では2個、HOXB13遺伝子では1個見つかりました(図1)。このうち、ATMとHOXB13で見つかった2個のバリアントは、これまでClinVarに登録のない新しい病的バリアントでした。
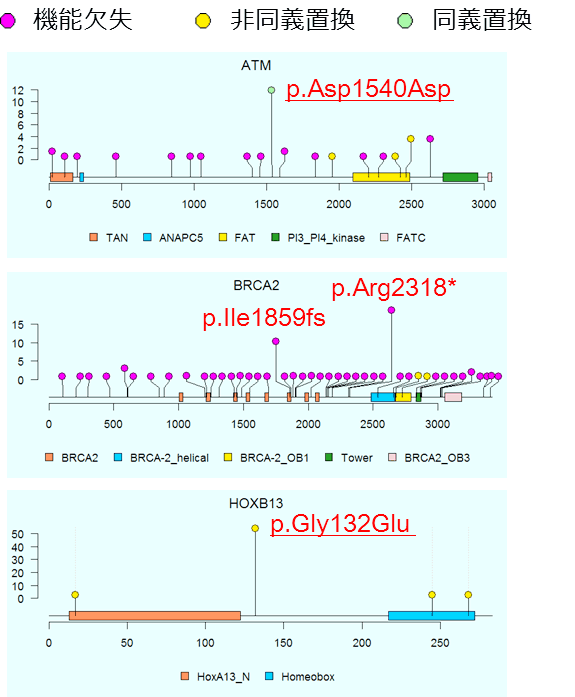
図1 ATM、BRCA2、HOXB13遺伝子に存在する病的バリアントの位置と保有人数
また、これら136個の病的バリアントを、疾患群・対照群それぞれがどのくらいの割合で持っているかを調べました。その結果、8遺伝子全体では、疾患群の2.9%、対照群の0.8%が病的バリアントを持っており、病的バリアントを持つことで前立腺がんへのなりやすさが約3.7倍高まることが明らかになりました(表1)。また遺伝子ごとでは、BRCA2、HOXB13、ATMの3遺伝子が前立腺がん発症に寄与していることが分かりました(表1)。
2017年のPhiladelphia Prostate Cancer Consensus Conferenceの報告では、BRCA1の前立腺がん発症への寄与は十分な根拠があるとされていました注7)が、本研究では疾患発症との関係は明確ではないことが分かりました。また、この報告や他の論文で示唆されているPALB2、BRIP1、NBNといった遺伝子に存在する病的バリアントが原因となって、前立腺がんを発症している患者はほとんどいませんでした。
- 注7)
- J Clin Oncol. 2018 Feb 1;36(4):414-424.
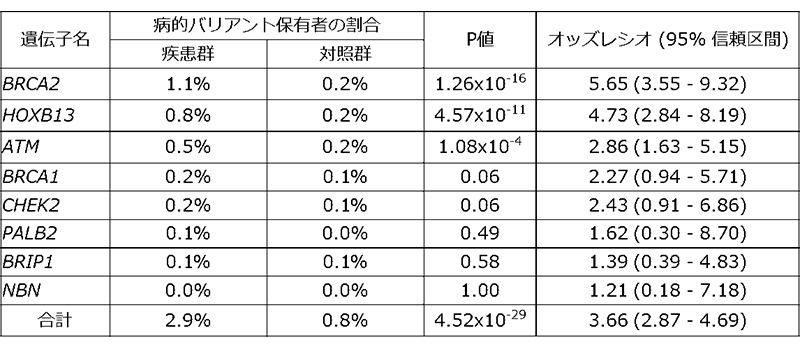
表1 本研究で明らかになった前立腺がん原因遺伝子別の病的バリアント保有者と発症リスク
次に、病的バリアント保有者がどのような臨床的特徴を持っているかを調べたところ、病的バリアント保有者は非保有者よりも前立腺がんと診断される年齢が2歳若いこと、喫煙歴や飲酒歴がある人が多いこと、また家族に乳がん、膵がん、肺がん、肝がん患者がいる割合が大きいこと、臨床症状もTNM分類[7]、グリソンスコア[8]、PSA(前立腺特異抗原)[9]などの項目が悪いことが明らかになりました(表2)。
一方で、前立腺がんの保有者は前立腺がんの家族歴があることがよく知られていましたが、本研究では確認されませんでした。これは、海外のデータに比べて、今回解析に使用したデータでは家族に前立腺がん患者がいる割合が小さいためだと考えられます。しかし、近年、日本でも前立腺がん患者が急激に増えていることから、近い将来、前立腺がんの家族歴も病的バリアント保有者の臨床的特徴となり得ると考えられます。
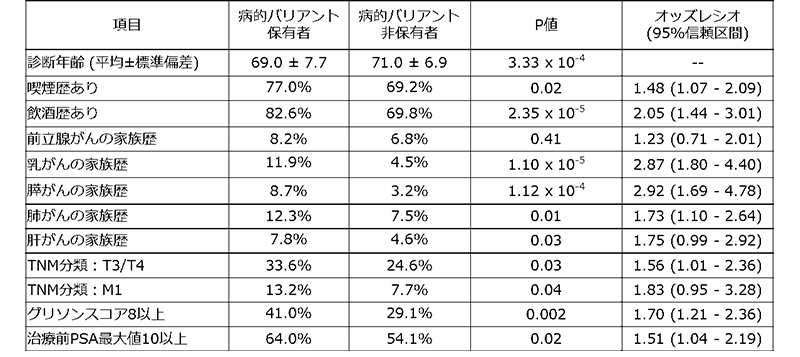
表2 病的バリアント保有者の臨床的特徴
最後に、前立腺がん診断年齢ごとに遺伝子バリアント保有者の割合を調べたところ、60歳未満では7.9%と高い割合で見つかり、年齢が上がるごとにその割合は少なくなりましたが、65歳以上では2-3%程度でほぼ変わらないことが分かりました(図2)。一つの病的バリアントにより発症する遺伝性疾患は、通常は早期に発症すると考えられていますが、乳がんの場合と同様に、高齢であっても一定の寄与があり、遺伝子検査をする意義があることが分かりました。
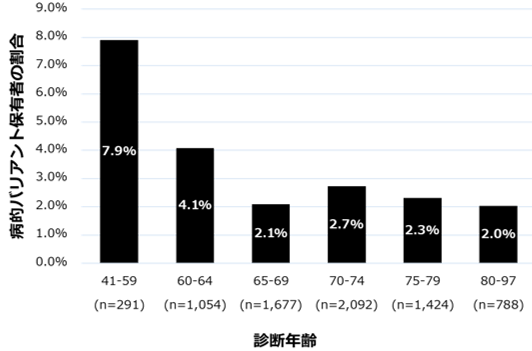
図2 前立腺がん診断年齢ごとの病的バリアント保有者の割合
本研究で得られた各バリアントのサマリー情報は、日本の臨床ゲノム情報統合データベース(MGeND)注8)のほか、海外のデータベースにも登録され、臨床現場における遺伝子バリアントの解釈について重要な情報としての利用が期待されます。
今後の期待
今回明らかにした遺伝子・疾患発症リスク・臨床情報の大規模データは、今後、前立腺がんの患者一人一人にあったゲノム医療を行う上で重要な情報となると期待できます。
また、今回解析した病的バリアントを含む遺伝子は卵巣がんや膵がんなど様々ながんの原因となることが示唆されていますが、これらの遺伝子に病的バリアントを持つ患者には、がんの種類を越えてPARP阻害剤などの治療効果が高いことが報告され始めています。その恩恵を享受するためにも、今後、他のがん種についても同様の大規模解析が必要であると考えられます。
論文情報
- タイトル
- Germline pathogenic variants in 7,636 Japanese patients with prostate cancer and 12,366 controls
- 著者名
- Yukihide Momozawa, Yusuke Iwasaki, Makoto Hirata, Xiaoxi Liu, Yoichiro Kamatani, Atsushi Takahashi, Kokichi Sugano, Teruhiko Yoshida, Yoshinori Murakami, Koichi Matsuda, Hidewaki Nakagawa, Amanda B. Spurdle, Michiaki Kubo
- 雑誌
- Journal of the National Cancer Institute
- DOI
- 10.1093/jnci/djz124
補足説明
- [1] 病的バリアント、遺伝子バリアント
- ヒトのDNA配列は30億の塩基対からなるが、その配列の個人間の違いを遺伝子バリアントという。そのうち、疾患発症の原因となるものを病的バリアントと呼ぶ。
- [2] バイオバンク・ジャパン
- 日本人集団27万人を対象とした、世界最大級の疾患バイオバンク。オーダーメイド医療の実現プログラムを通じて実施され、ゲノムDNAや血清サンプルを臨床情報と共に収集し、研究者へ分譲を行っている。2003年から東京大学医科学研究所内に設置されている。
- [3] ゲノムワイド関連解析(GWAS)
- ゲノムワイド関連解析は、人のゲノム全体をほぼカバーする場所の、一塩基多型(SNP)を代表とする配列多様性の遺伝子型を決定し、遺伝子型の頻度の集団的偏り(特に患者と一般集団との間の)と、病気や表現型との関連を統計的に調べる方法。GWASはGenome Wide Association Studyの略。
- [4] 一塩基多型(SNP)
- 集団のゲノム配列中でみられる一塩基の違い(個人差、多様性)で、特に、集団の1%以上に違いが認められる場合に、一塩基多型と呼ぶ。SNPはSingle Nucleotide Polymorphismの略。
- [5] PARP阻害剤
- DNAの相同組換え修復機構が機能していないがん細胞に、特異的に細胞死を誘導する新しい分子標的薬のこと。PARPはPoly (ADP-Ribose) Polymeraseの略。
- [6] ロリプロット
- 遺伝子バリアントのアミノ酸配列上での位置と保有する人数の関係を示した図。その形が、棒付きの飴(ロリポップ)に似ていることから、ロリプロットと呼ぶ。
- [7] TNM分類
- がんの大きさ、リンパ節への広がり、遠隔転移についての病期の分類法の一つ。
- [8] グリソンスコア
- 前立腺がんのがん細胞の組織像に基づき定められる悪性度の指標。
- [9] PSA(前立腺特異抗原)
- 血液中に含まれる濃度を測定することで、前立腺がんの早期発見のために使われる。PSAは、Prostate Specific Antigenの略。
発表者・機関窓口
発表者
理化学研究所 生命医科学研究センター 基盤技術開発研究チーム
チームリーダー 桃沢 幸秀(ももざわ ゆきひで)
東京大学 医科学研究所
教授 村上 善則(むらかみ よしのり)
栃木県立がんセンター ゲノムセンター
ゲノムセンター長 菅野 康吉(すがの こうきち)
国立がん研究センター 中央病院 遺伝子診療部門
部門長 吉田 輝彦(よしだ てるひこ)
機関窓口
理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
E-mail:ex-press“AT”riken.jp
東京大学医科学研究所事務部管理課総務チーム
TEL:03-6409-2018 FAX:03-5449-5402
E-mail:t-soumu“AT”ims.u-tokyo.ac.jp
栃木県立がんセンター ゲノムセンター
ゲノムセンター長 菅野 康吉
TEL:028-658-5151 FAX:028-658-5669
国立研究開発法人国立がん研究センター企画戦略局 広報企画室
TEL:03-3542-2511(代表) FAX:03-3542-2545
E-mail:ncc-admin“AT”ncc.go.jp
AMED事業に関するお問い合わせ先
日本医療研究開発機構(AMED)
基盤研究事業部 バイオバンク課
TEL:03-6870-2228 E-mail:order-made“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和元年7月17日
最終更新日 令和元年7月17日


