プレスリリース RSウイルス感染が細菌性肺炎を誘発するメカニズムを発見―二次性細菌性肺炎の新規予防・治療法の開発への期待―
プレスリリース
国立研究開発法人日本医療研究開発機構
ポイント
- RSウイルス感染は細菌性肺炎を誘発するが、これまでに肺炎を誘発するメカニズムはわかっていなかった。
- RSウイルスに感染すると免疫応答が抑制され、その後に感染した肺炎球菌が爆発的に増殖し、肺炎が誘発されることを発見した。
- RSウイルス感染により誘導されるGas6/Axlシグナルの活性化が抗菌能の低いM2マクロファージを誘導することを発見した。
- Axl阻害剤はRSウイルス感染に伴う免疫応答の抑制を解除し、二次感染による細菌性肺炎の予防・治療薬になる可能性がある。
概要
国立感染症研究所免疫部主任研究官(研究当時)の柴田岳彦准教授(東京医科大学微生物学分野)、同免疫部の高橋宜聖部長、同感染制御部の阿戸学部長らの研究グループは、RSウイルス感染*1によって誘導される二次性細菌感の免疫学的メカニズムを発見しました。本研究グループはRSウイルス感染後の二次性細菌感染マウスモデルを作製することにより、RSウイルス感染によって生じるgrowth arrest specific 6(Gas6)/Axlシグナル*2が生体の免疫応答を抑制し、細菌感染を容易にすることを明らかにしました。さらに、RSウイルス感染後でも阻害剤の投与によりAxlシグナルを遮断すれば、細菌のクリアランスが正常化し、重症感染を免れることも判明しました。本研究成果は、2020年5月4日16時(米国東部標準時間)米国科学誌「The Journal of Clinical Investigation」に掲載されます。
本研究の成果は、ウイルス感染に伴う二次性細菌性肺炎に対する新しい予防・治療法の開発につながることが期待されます。
研究の背景
呼吸器感染症をひき起こすrespiratory syncytial virus(RSウイルス)は、ほぼ100%の乳幼児が2歳までに感染し、健康な成人であればその感染により風邪の症状が出る程度で済むことがほとんどです。一方、乳児や高齢者は重症化リスクが高く、細気管支炎や肺炎が誘発されることがあります。実はこのような重症患者では、RSウイルスそのものではなく肺炎球菌*3などによる細菌性肺炎がしばしば見受けられます。しかし、こうした二次感染による細菌性肺炎の認知度や関心は低く、これまでにRSウイルス感染後にどのように細菌感染が生じるのか、そのメカニズムの解明に至っていませんでした。
研究の成果
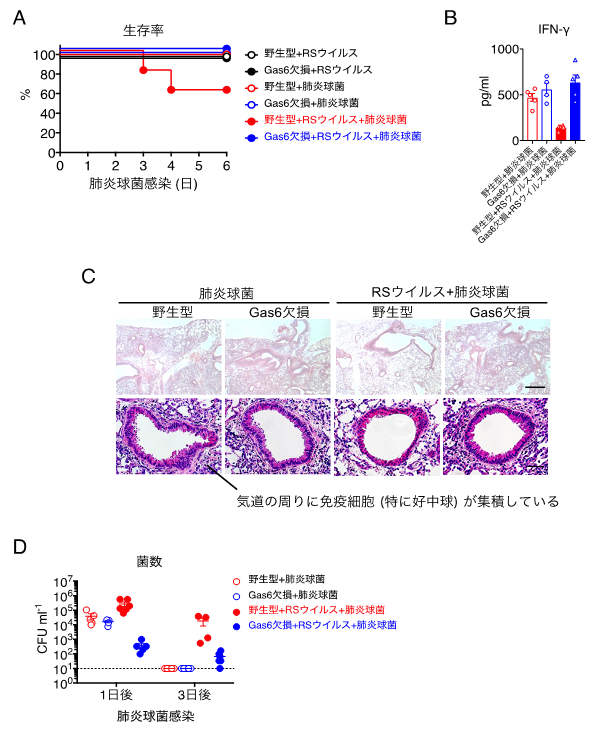
本研究グループは、RSウイルス感染後の二次性細菌感染のモデルとして、野生型とGas6欠損型(KO)のマウスを用いて検討することにより、RSウイルス感染後に細菌性肺炎が生じるメカニズムを明らかにしました(図1)。RSウイルスに感染した後、肺炎球菌に感染すると野生型のマウスでは一定の割合で生存率が低下するのに対して、Gas6 KOマウスではそのような低下はみられませんでした(図2A)。野生型のマウスがRSウイルスに感染すると、その後の肺炎球菌感染に伴うIFN-γ*4など炎症性サイトカインの産生(図2B)や免疫細胞の浸潤(図2C)などの免疫応答が抑制されることが判明しました(図2D)。そして、RSウイルスに感染した野生型マウスでは肺炎球菌のクリアランスが遅れることが判明しました。一方、Gas6 KOマウスでは二次感染グループであっても、これら免疫応答の抑制は解除されました。このメカニズムを詳しく調べてみると、RSウイルス感染後のマクロファージ*5は抗菌能の低いM2様マクロファージに分極していることがわかりました。さらに、RSウイルスの感染に伴い気道上皮細胞や肺胞マクロファージから産生されるGas6と肺胞マクロファージに発現するAxlが結合すると、M2様マクロファージを誘導することを見出しました。このM2様マクロファージは、インターロイキン(IL)-18*6やCXCL2*7の産生能が低いため、ナチュラルキラー(NK)細胞*8からのインターフェロン(IFN)-γ産生や好中球*9の浸潤をほとんど誘導できず、結果的に肺炎球菌が爆発的に増え、重症感染に陥ることがわかりました。一方、RSウイルス感染後でも、Axlに対する阻害抗体や阻害剤によりGas6からのシグナルを阻害すれば、M2様マクロファージへの分極が抑制され、適切な炎症応答となることにより肺炎球菌のクリアランスが正常化し、重症化しないことが判明しました。
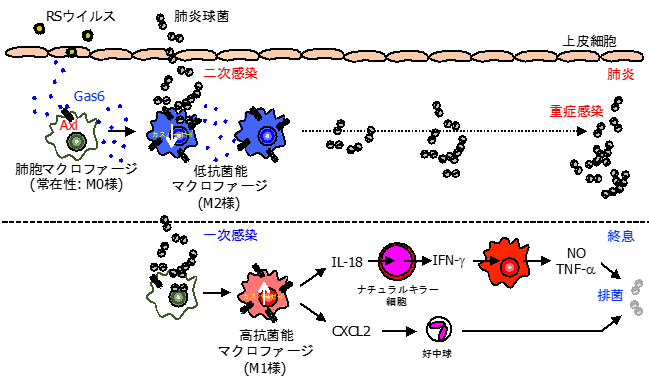
今後の研究展開および波及効果
肺炎は日本における死因の第5位です。その原因は様々ですが、本研究グループの発見は少なくともRSウイルス感染に伴う二次性細菌性肺炎に対する新しい予防・治療法の開発につながることが期待されます。今後、この発見がその他のウイルスや細菌の感染による免疫応答や重症化の理解に役立つとともに、二次感染モデルを用いた免疫応答に関する研究がますます有意義になってくることが予想されます。
研究協力者
本研究は、本研究グループと東京医科大学医学部微生物学分野 中村茂樹主任教授、東邦大学理学部生物分子科学科 永田喜三郎教授、奈良県立医科大学医学部免疫学講座 伊藤利洋教授、高知大学医学部小児思春期医学 藤枝幹也教授の研究グループと共同で行ったものです。
本研究への支援
本研究は、日本医療研究開発機構(AMED)新興・再興感染症に対する革新的医薬品等開発推進研究事業(研究代表者 高橋宜聖 JP18fk0108051)、日本学術振興会科学研究費 若手研究A(研究代表者 柴田岳彦 JP16K19167)、武田科学振興財団(研究代表者 柴田岳彦)の一環として行われました。
発表論文
- 雑誌名:
- The Journal of Clinical Investigation
- タイトル:
- Respiratory syncytial virus infection exacerbates pneumococcal pneumonia via Gas6/Axl-mediated macrophage polarization
- 著者:
- Takehiko Shibata, Airi Makino, Ruiko Ogata, Shigeki Nakamura, Toshihiro Ito, Kisaburo Nagata, Yoshihiko Terauchi, Taku Oishi, Mikiya Fujieda, Yoshimasa Takahashi, and Manabu Ato
用語説明
- *1 RSウイルス
- 呼吸器感染症をひき起こすウイルス。パラミクソウイルス科のニューモウイルス属に分類されるエンベロープを持つRNAウイルスである。
- *2 Gas6(growth arrest specific 6)/Axlシグナル
- 上皮細胞の細胞増殖因子として見つけられ、アポトーシス細胞の貪食に関与するタンパク質として広く知られている。受容体はTyro、Axl、Mertkであり、TAMレセプターと総称される。ここ10年間では、特に免疫応答の抑制作用に注目されている。さらに最近では、Axlはがん細胞の増殖促進作用を持つことから、抗癌剤開発の標的となっている。
- *3 肺炎球菌
- 肺炎球菌はグラム陽性菌で、主要な呼吸器病原性菌のひとつである。本菌は乳幼児の鼻咽頭に40~60%と高頻度に保菌されている。
- *4 インターフェロンガンマ(IFN-γ)
- 主にT細胞やナチュラルキラー細胞から分泌されるサイトカインで、免疫応答促進に働き、ウイルスや細菌の病原体、がん細胞の排除に働く。また、マクロファージや樹状細胞を刺激して細菌を貪食殺菌させる作用もある。
- *5 マクロファージ
- 細菌などの微生物やアポトーシス細胞を食べる(貪食)細胞。その機能から大まかにM1様マクロファージとM2マクロファージに分類される。前者は、炎症反応により微生物感染に防御的に働き、後者は抗炎症炎反応を示し組織修復などに関与する。肺胞マクロファージはM0様として肺胞に常在している。
- *6 インターロイキン-18(IL-18)
- 18kDaのサイトカインで、IFN-γを誘導する因子。通常IL-18は細胞内に存在するが、活性型カスパーゼ-1によって切断され、成熟型のサイトカインとして細胞外に分泌される。
- *7 CXCL2
- MIP-2(macrophage inflammatory protein-2)とも呼ばれるケモカイン。好中球のCXCR2に結合し、炎症局所に好中球を浸潤させる。
- *8 ナチュラルキラー細胞(NK細胞)
- ウイルスや細菌などに感染した細胞やがん細胞を攻撃するリンパ球。
- *9 好中球
- マクロファージとともに肺炎球菌のクリアランスに重要な細胞。
お問い合わせ先
AMED事業に関するお問い合わせ先
日本医療研究開発機構 創薬事業部 創薬企画・評価課
〒100-0004 東京都千代田区大手町1-7-1
E-mail:shinkou-saikou"AT"amed.go.jp
研究に関するお問い合わせ先
東京医科大学 微生物学分野
准教授 柴田岳彦
〒162-8402 東京都新宿区新宿6-1-1
Tel:03-3351-6141 Fax:03-3351-6160
E-mail:tshibata"AT"tokyo-med.ac.jp
(取材に関する連絡は以下にお願いします)
東京医科大学 総務部広報・社会連携推進課
〒162-8402 東京都新宿区新宿6-1-1
Tel:03-3351-6141 Fax:03-6302-0289
E-mail:d-koho"AT"tokyo-med.ac.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和2年5月5日
最終更新日 令和2年5月5日


