成果情報 エクソソームへの輸送を担う新しい翻訳後修飾因子UBL3を世界で初めて発見
成果情報
浜松医科大学
藤田保健衛生大学
日本医療研究開発機構
本研究のポイント
- 癌転移や神経筋変性などの様々な疾患において今後の治療に期待できます。
- UBL3による翻訳後修飾に新たな創薬フィールドの可能性が期待できます。
背景
脂質は水に溶けないため、タンパク質に結合する、会合体を作る、さらには細胞外小胞の成分になる、などで体内を循環すると考えられています。こうした細胞外小胞はナノメートルサイズの大きさで、タンパク質やmRNA、miRNAが含まれており、放出した細胞の性質を反映していて、様々な疾患に関与していると考えられ始めています。
我々は以前、タンパク質修飾酵素の一つとしてSCRAPPERを同定しました(Yao et al., Cell 2005)。昨年、質量分析技術と顕微鏡技術を駆使して、比較的大型の細胞外小胞の生成に脂質修飾が必要なことを示しました(Ikegami et al., Cell 2017)。
今回、我々はやはり質量分析と顕微鏡を駆使した本研究において、UBL3/MUBというタンパク質が他のタンパク質に共有結合による翻訳後修飾(注2)と呼ばれる結合をすることを発見し、さらにその翻訳後修飾が特定タンパク質の比較的小型の細胞外小胞(エクソソーム)(注1)への輸送を制御することを証明しました。
研究手法と成果
今回、我々は、脂質修飾される配列を持つことを目印にして、進化保存性の高いユビキチン様タンパク質(注3)UBL3に着目し研究を行ないました。UBL3は117個のアミノ酸から構成されています。システイン残基Cys113とCys114を改変することで、UBL3を介した翻訳後修飾が消失することから、UBL3はCys113とCys114を介したターゲットプロテインと結合していることが分かりました。このシステイン残基を改変したUBL3C113A, UBL3C114A, UBL3C113/114A変異体では、多胞体と呼ばれるオルガネラへの局在化を示さないことから、システイン残基を介した翻訳後修飾がUBL3の局在に必須であることがわかりました。
次に、UBL3による細胞外小胞へのタンパク質輸送制御を確かめるために,Ubl3欠損マウスの血清中から細胞外小胞を精製し、野生型マウスの細胞外小胞と比較した結果、含有する総RNAや、濃度、直径には変化が無かったのに対し、Ubl3欠損マウスの細胞外小胞の総タンパク質量は野生型マウスと比べて60%低かったことより、UBL3が細胞外小胞へのタンパク質輸送に関与することがわかりました。
そして、UBL3に対する結合分子同定のために質量分析技術を用いて網羅的プロテオミクス解析を行った結果、1241個のタンパク質が見つかり、その中に発がん遺伝子として知られるRasを含む疾患関連タンパク質が20個以上含まれていることがわかり、発がん性RasG12V変異体もUBL3による翻訳後修飾によって細胞外小胞への輸送量が増大し、この細胞外小胞を培養細胞へ投与すると、取り込まれた細胞において細胞内シグナルが増大することもわかりました。このことから、UBL3が細胞外小胞を介した細胞間連絡に関与しているということを示しています。
また、光学顕微鏡を用いて、UBL3を結合させた緑色蛍光タンパク質やビオチンタンパク質は、細胞培養液中の細胞外小胞に濃縮している事から、UBL3が細胞外小胞へのタンパク質輸送のタグとして機能する事も明らかにしました。
以上の事から、我々が見出したUBL3による新規翻訳後修飾が特定タンパク質の細胞外小胞への輸送を制御する事が分かり、新たなタンパク質の輸送システム開発としての応用性があることが解析されました(図2)。エクソソームによる細胞間情報伝達は、癌転移や神経筋変性などの様々な疾患において重要であるため、UBL3による翻訳後修飾が新たな創薬ターゲットになる可能性を示しています。
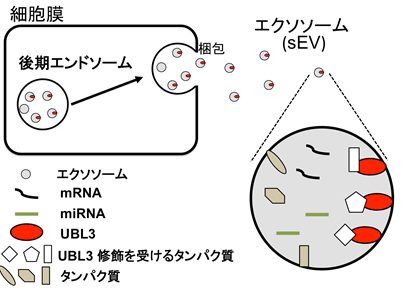
図1 ユビキチン様タンパク質UBL3による修飾とエクソソームの関係図
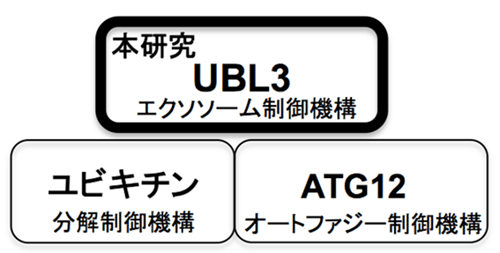
図2 ユビキチン様タンパクを介した翻訳後修飾による制御機構
今後の期待
本研究では、脂質とタンパク質の複合翻訳後修飾因子UBL3を質量分析と光学顕微鏡を駆使して世界で初めて発見しました。さらにUBL3による新規翻訳後修飾が特定タンパク質のエクソソームへの輸送を制御するということ、そしてユビキチンシステムやオートファジーシステムと並ぶ新たなタンパク質の輸送システム開発としての応用性があることを解析しました。本研究成果により、今後、癌転移や神経筋変性などの様々な疾患においての治療に期待でき、またUBL3による翻訳後修飾に新たな創薬フィールドの可能性が期待できます。
本研究は、藤田保健衛生大学・総合医科学研究所の上田助教・土田教授と浜松医科大学の瀬藤教授との共同で行ったものです。
本研究成果は、2018年9月26日18時(英国時間:午前10時)発行の英国科学誌「Nature Communications」に掲載されました。
研究支援
本成果は、以下の事業・研究課題等によって得られました。
日本学術振興会科学研究費補助金 基盤研究(C)(上田、土田)、萌芽研究(上田)、
精神・神経疾患研究開発費(26-8, 29-4)(土田)
革新的先端研究開発支援事業(AMED-CREST)「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明」研究開発領域(研究開発総括:横山信治)「光による脂質の同定制御観察技術すなわちオプトリピドミクスの創生(研究代表者:瀬藤光利)
用語解説
- 注1)小型細胞外小胞(small extracellular vesicle, sEV)
- sEVの一部は、エクソソームとも呼称され、ほぼ全ての細胞種から多胞体Multivesicular Body(MVB)を介して細胞外へ放出される小胞であり、産生細胞に由来する特定のタンパク質やmiRNAを内包し標的細胞に再び取り込まれることで新たな細胞間コミュニケーションとして働き、癌転移や神経筋変性などの疾患を含めた様々な生命現象に関与している。特定タンパク質のエクソソームへの輸送機構は不明であった。
- 注2)翻訳後修飾
- ゲノムから転写されたmRNAは、リボソームにより翻訳されタンパク質となる。翻訳後にアミノ酸に対して、リン酸基、アセチル基、脂質、タンパク質など修飾因子が付加される現象を翻訳後修飾と呼ぶ。
- 注3)ユビキチン様タンパク質(Ubiquitin like protein)
- ユビキチンは、他のタンパク質へ翻訳後修飾因子として付加する事によって、局在変化やタンパク質の安定性を変化させる。このユビキチンに構造上類似したタンパク質の事をユビキチン様タンパク質と呼ばれている。ユビキチン様タンパク質として、SUMOやNEDD8やオートファジーに関与するATG12などが知られ、ユビキチンと同様に翻訳後修飾因子として機能する事が知られている。
論文名
- タイトル
- “UBL3 modification influences protein sorting to small extracellular vesicles”
(UBL3化修飾は小型細胞外小胞へのタンパク質輸送に影響を及ぼす) - 雑誌名
- Nature communications
- DOI:
- 10.1038/s41467-018-06197-y (2018)
お問い合わせ先
研究内容に関すること
瀬藤光利
浜松医科大学 医学部
細胞分子解剖学講座 教授
〒431-3192 浜松市東区半田山1丁目20番1号
Tel:053-434-5282
Email:setou"AT"hama-med.ac.jp
土田邦博
藤田保健衛生大学 総合医科学研究所
難病治療学 教授
〒470-1192 愛知県豊明市沓掛町田楽ヶ窪1番地98
Tel:0562-93-9384
Email:tsuchida"AT"fujita-hu.ac.jp
上田洋司
藤田保健衛生大学 総合医科学研究所
難病治療学 助教
〒470-1192 愛知県豊明市沓掛町田楽ヶ窪1番地98
Tel:0562-93-9393
Email:hiage"AT"fujita-hu.ac.jp
報道・プレスリリースついて
藤田保健衛生大学 広報部 学園広報課
〒470-1192 愛知県豊明市沓掛町田楽ヶ窪1番地98
Tel:0562-93-2492
Email:koho-pr"AT"fujita-hu.ac.jp
浜松医科大学 広報室
〒431-3192 浜松市東区半田山1丁目20番1号
Tel:053-435-2151
E-mail:koho"AT"hama-med.ac.jp
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
東京都千代田区大手町1−7−1 読売新聞ビル
TEL:03-6870-2224
E-mail:kenkyuk-ask"AT"amed.go.jp
※E-mailは上記アドレス”AT”の部分を@に変えてください。
掲載日 平成30年10月17日
最終更新日 平成30年10月17日


