肝臓がんのゲノムを新手法で解析―B型肝炎ウイルスによる新たな発がんメカニズムを発見―
成果情報
国立研究開発法人国立がん研究センター
国立研究開発法人日本医療研究開発機構
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)研究所がんゲノミクス研究分野(分野長 柴田 龍弘)は、第3世代のシークエンサーを用いた最新の解析方法でB型肝炎陽性肝臓がん108症例を含む、日本人の肝臓がん373症例のゲノム解析を行いました。
その結果、B型肝炎ウイルスに感染後、肝炎から肝臓がんに至る新たな発がんメカニズムを発見しました。今後、さらに研究を進め、肝臓がん予防への応用を目指します。また本研究では、これまで十分に解析されていなかった肝臓がんのゲノム異常とエピゲノム異常や喫煙・飲酒など発がん要因との関連についても明らかにしました。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の支援により行ったもので、研究成果は英国専門誌「Nature communications」に2018年4月24日付で発表されました。さらに本論文は、同誌において、ゲノム・エピゲノム領域における特筆すべき論文(Editors’ Highlights)として選抜、紹介されました。
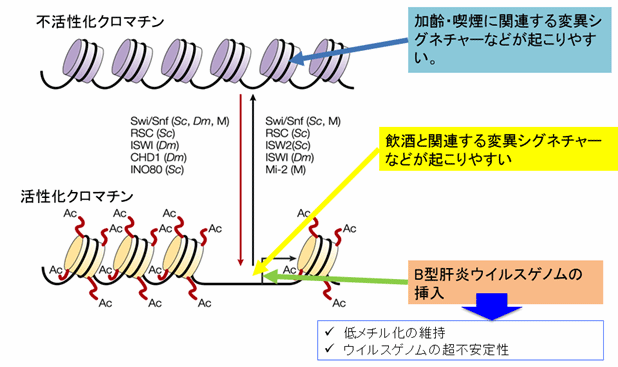
がん細胞におけるエピゲノム以上がゲノム異常を起こしやすい環境を生み出している
Tsukiyama, T. Nat. Rev. Mol. Cell Biol. 3, 422–429 (2002) の図を借用した。日本語の箇所は著者らが追加した。
研究背景
肝臓がんは日本でのがん死亡者数第5位を占める難治がんです。その発症には、肝炎ウイルスの感染や飲酒等による肝炎・肝硬変が重要な危険因子であることが知られています。しかし、このような肝障害がなぜがんの発生につながるのか、なぜ特定の患者さんでがんが発生するのかは不明で、その解明は肝臓がんの予防や早期発見にとって重要な研究です。
これまでの研究から、肝臓がんの発症には、遺伝子の点突然変異、染色体構造異常、ウイルス感染によるウイルスゲノムの挿入によるゲノム異常、メチル化異常に代表されるエピゲノム異常が関与していることが知られています。しかし、こうしたゲノム異常とエピゲノム異常など様々な関連について全ゲノム規模での解析は行われておらず、それぞれがどのように関連して肝臓がんの発生に寄与しているのか明らかになっていませんでした。
研究概要
本研究では、肝臓がんの発生におけるゲノム異常とエピゲノム異常の関連を検討するために、全ゲノムと全エピゲノムの解析に加えて、第3世代シークエンサー*1(Pac Bio)による全ゲノム解読、ゲノム濃縮法によるウイルスゲノム解析といった新たな解析手法を行い、全部で373症例の肝臓がん症例について解析を進めました。その結果、肝臓がんのゲノム及びエピゲノム異常とB型肝炎ウイルス感染や飲酒などの発がん要因との関連を明らかにし、肝臓がんの新たな発症メカニズムを発見しました。
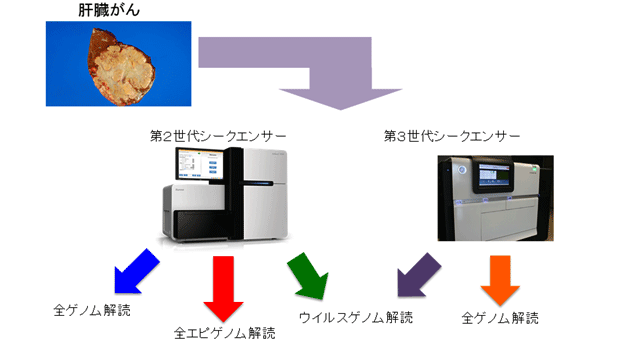
本研究における実験の流れ
研究結果
1.がん細胞のメチル化異常(エピゲノム異常)がゲノム異常を起こしやすい環境を生み出している
全ゲノム・全エピゲノムシークエンス解読の結果から、肝臓がんにおける突然変異や染色体構造異常は、特徴的なエピゲノム*2状態を示すゲノム領域に有意に濃縮していることが明らかとなりました。その領域とは、①がん細胞で特異的に低メチル化を起こしている領域、②がん細胞で活発に遺伝子発現している領域の2つで、この結果からがん細胞におけるメチル化異常(エピゲノム異常)がゲノム異常を起こしやすい環境を生み出していることが明らかになりました。
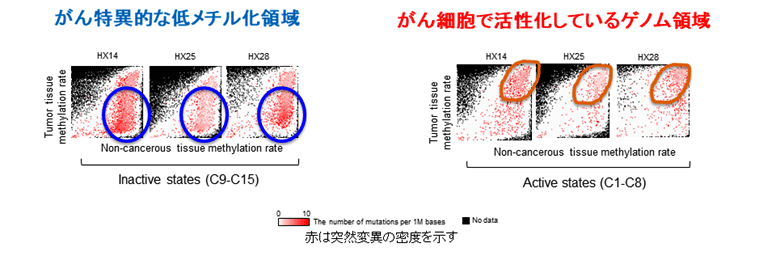
がんにおけるゲノム異常が起こりやすい2つの特徴的な領域
2.種々の発がん要因による遺伝子変異の起こりやすさにもエピゲノム状態が重要
喫煙や発がん物質暴露といった様々ながんの原因と関連している変異シグネチャー*3の分布を調べた結果、これらはゲノム全体に均一に分布しているわけではなく、特徴的なクロマチン状態*4(エピゲノム状態の一部)に応じて偏って存在していることが分かりました。つまり、各発がん要因による遺伝子変異の起こりやすさにはクロマチン状態によって違いがあることが明らかになりました。特に、肝がんに特徴的な変異シグネチャー(下図bの黒で示したシグネチャーで、飲酒によって生じるとの説が有力)は活性型クロマチンに多く分布していましたが、不活性型クロマチンにはわずかしか見られませんでした。
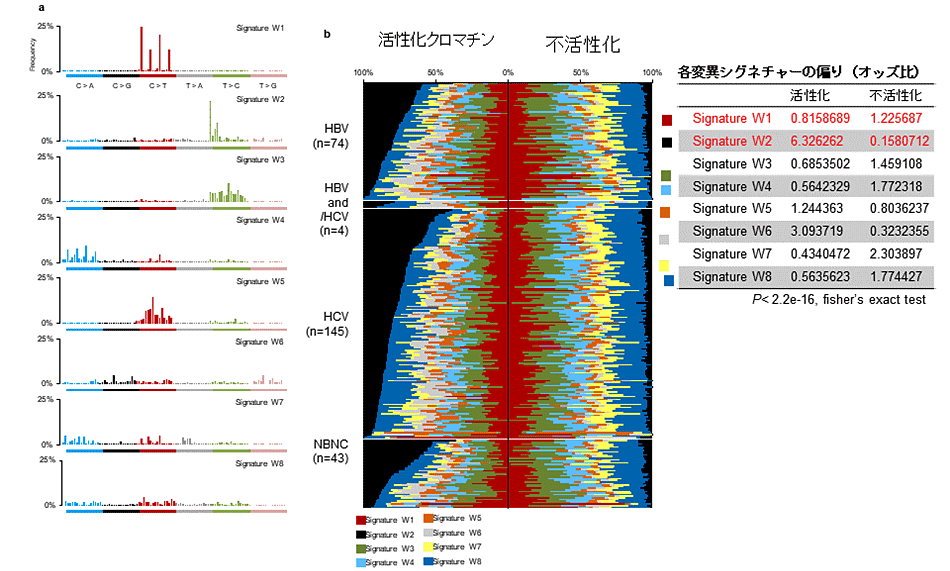
エピゲノム(クロマチン)状態によって起こりやすい変異シグネチャーは異なる
3.B型肝炎ウイルス感染から発がんに至る新しいメカニズムを発見
B型肝炎ウイルスに感染した肝細胞においては、ヒトゲノムへのB型肝炎ウイルスゲノムの挿入がしばしば観察され、ドライバー遺伝子の活性化を起こすなど肝がんの発生に重要であることをこれまでに報告してきました(十時ら, Nature Genetics, 2014)。しかしその挿入が一体どういったゲノム領域で起こっているのかといった全体像については十分に解明されていませんでした。
本研究では、ゲノム濃縮法を用いて108症例のB型肝炎陽性肝臓がん並びに背景の肝炎組織におけるB型肝炎ウイルスゲノムを網羅的に検索しました。その結果、背景の肝炎組織におけるB型肝炎ウイルスゲノムの挿入は活性化クロマチン状態を示す領域に挿入が起こりやすい一方で、肝臓がん細胞ではこうした挿入の一部が除かれていることが分かりました。つまりB型肝炎ウイルスゲノムの挿入は肝炎からがん細胞への過程で大きく変化しており、感染した細胞のうちどの細胞ががん化するのかという選択において重要な役割を果たしていることが推測されました。
また全エピゲノムシークエンスに加えて第3世代シークエンサーを用いた全ゲノム解読の結果から、挿入されたB型肝炎ウイルスゲノムは低メチル化のまま維持され、一部では激しい構造異常を示していました。こうしたウイルスゲノムの不安定性もB型肝炎ウイルスによる肝臓がん発症の重要な分子機構の一つであると考えられました。
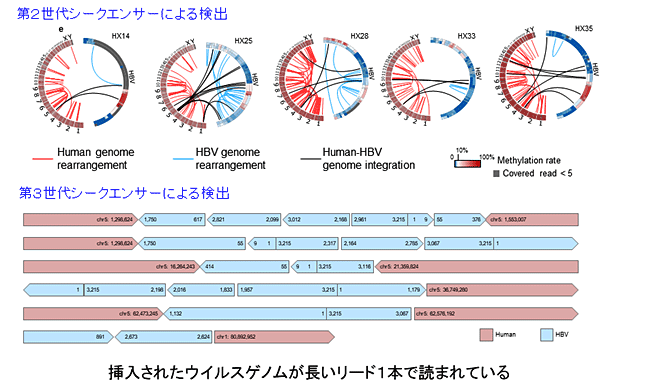
挿入されたB型肝炎ウィルスゲノムの不安定性
展望
本研究によって、B型肝炎陽性肝臓がんにおけるゲノム異常とエピゲノム異常の新たな関係、およびB型肝炎ウイルスゲノム挿入とエピゲノム異常との新たな関係が明らかとなりました。この結果によって、肝炎ウイルス感染やその結果起こる肝炎がどのように肝がんを引き起こすのかという仕組みの詳細が明らかとなりました。この結果を肝臓がんの予防に応用するために、更にその関係性の背景にある分子機構(なぜそういう関係が成立しているのか)を解き明かす必要があり、今後も研究を進めます。
研究費
国立研究開発法人日本医療研究開発機構(AMED)
革新的がん医療実用化研究事業
「国際共同研究に資する日本人難治性がん・生活習慣病関連がん大規模統合ゲノミクス解析と国際コンソーシアムでのデータ共有による国際貢献」
国立研究開発法人日本医療研究開発機構(AMED)
革新的先端研究開発支援事業(エピゲノム研究に基づく診断・治療へ向けた新技術の創出)(CREST)
「ヒト消化器上皮細胞の標準エピゲノム解析と解析技術開発」
発表論文
- 雑誌名:
- Nature Communications
- タイトル:
- Epigenetic landscape influences the liver cancer genome architecture.
- 著者:
- Hama N, Totoki Y, Miura F, Tatsuno K, Saito-Adachi M, Nakamura H, Arai Y, Hosoda F, Urushidate T, Ohashi S, Mukai W, Hiraoka N, Aburatani H, Ito T, Shibata T.
- DOI:
- 10.1038/s41467-018-03999-y.
用語解説
- *1 第3世代シークエンサー
- 第2世代シークエンサーでは、ショートリードと呼ばれる、ゲノムを短く切って100塩基前後の配列を読み取ったデータが得られますが、第3世代シークエンサーでは数1000塩基以上のロングリードが得られ、様々なゲノム異常が起こっている領域をひと続きで読み取ることができます。第3世代シークエンサーによって、これまで十分に解析できていなかった複雑な染色体構造異常やウイルスゲノム異常が明らかにできると期待されています。
- *2 エピゲノム
- ヒトの細胞は全て同じDNAを持っているが、臓器や細胞によってその役割が大きく異なっている。これは、同じDNA配列であっても、DNAの修飾(メチル化)やDNAに結合する様々なタンパク質(ヒストンなど)の状態が変化することで遺伝子の発現が調節されているからである。こうしたDNAやその結合蛋白の修飾による変化は、塩基配列を超えた上位の調節機構であるためエピゲノムと呼ばれる(エピ=上位)。肝がんを始め様々ながんにおいては、ゲノム異常に加えてこうしたエピゲノムの異常も起こっていることが知られている。
- *3 変異シグネチャー
- ゲノムに発生する様々な変異はがんの原因となる場合があると考えられているが、その変異の数や種類には、臓器やがん種によって特徴が表れることがある。著者らの研究グループでは、肝がんに特徴的に表れるチミン・シトシン塩基置換を以前に発表した(十時ら, Nature Genetics, 2014)。
- *4 クロマチン状態
- DNAは、核内ではヒストンと呼ばれるたんぱく質に巻き付いたヌクレオソームという形態をとっており、ヌクレオソームの集合体がクロマチンである。長いDNAが長さ約150塩基ずつヒストンたんぱく質に巻き付いて連なっており、2つのヌクレオソームの間隔が開いている状態を活性型クロマチン、詰まっている状態を不活性型クロマチンと呼ぶ。こうしたクロマチン状態は、同じゲノム配列でもヒストン蛋白の様々な化学的修飾によって調節されており(エピゲノムの一部)、遺伝子の発現に大きな影響を与えている。またクロマチン状態はDNAの構造に変化を起こすため、DNA損傷やその修復にも影響を与えることが知られている。
お問い合わせ先
研究内容に関するお問い合わせ先
国立研究開発法人国立がん研究センター
研究所 がんゲノミクス研究分野
分野長 柴田 龍弘
〒104-0045 東京都中央区築地5-1-1
TEL:03-3542-2511(代表) E-mail:tashibat"AT"ncc.go.jp
報道関係のお問い合わせ先
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
TEL:03-3542-2511(代表) FAX:03-3542-2545
E-mail:ncc-admin"AT"ncc.go.jp
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 がん研究課
TEL:03-6870-2221 E-mail:cancer"AT"amed.go.jp
※E-mailは上記アドレス"AT"の部分を@に変えてください。
掲載日 平成31年2月27日
最終更新日 平成31年2月27日


