成果情報 抗肥満薬が黄色ブドウ球菌の病原因子を阻害するメカニズムを解明
成果情報
京都工芸繊維大学
大阪府立大学
京都大学
理化学研究所
日本医療研究開発機構
発表者
北所 健悟(京都工芸繊維大学分子化学系 准教授)
神谷 重樹(大阪府立大学 総合リハビリテーション学研究科 教授)
奥野 友紀子(京都大学医学研究支援センター 特定講師)
引間 孝明(理化学研究所放射光科学研究センター利用システム開発研究部門 研究員)
山本 雅貴(理化学研究所放射光科学研究センター利用システム開発研究部門 部門長)
発表のポイント
- 黄色ブドウ球菌※1の病原因子「リパーゼ(SAL)」の立体構造を世界で初めて解明した。
- 抗肥満薬「オルリスタット※2」が黄色ブドウ球菌のSALを阻害し、既存の阻害剤よりも200倍以上強い阻害活性を持つことを見出すとともに、阻害のメカニズムを解明した。
- オルリスタットのようなSAL阻害剤は、既存の抗菌薬の効かないMRSA感染症※3や、黄色ブドウ球菌により引き起こされるアトピー性皮膚炎などの治療薬になることが期待できる。
発表概要
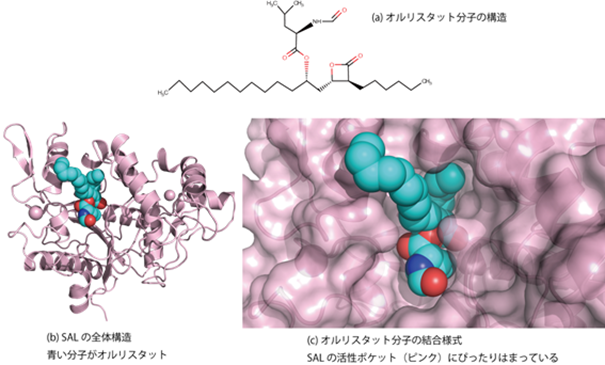
京都工芸繊維大学分子化学系の北所健悟准教授らの研究グループは、大阪府立大学総合リハビリテーション学研究科の神谷重樹教授、京都大学医学研究支援センターの奥野友紀子特定講師、理化学研究所放射光科学研究センター利用システム開発研究部門の引間孝明研究員、山本雅貴部門長らとの共同研究により、黄色ブドウ球菌※1が産生する病原因子の1つである「リパーゼ(SAL)」の立体構造をX線構造解析※4の方法を用いて、世界で初めて解明しました(図)。
また、抗肥満薬として市販されているヒトリパーゼ阻害剤「オルリスタット※2」が既存のSAL阻害剤よりも200倍以上SALの活性を阻害することを発見しました。更に、SALとオルリスタットとの複合体の構造を原子レベルで解析することによって、オルリスタットによる阻害のメカニズムを解明することに成功しました。
本研究成果は、構造情報を元にしたSALに対する薬剤の理論的な開発に役立つと考えられ、より有効性が高く副作用の少ない治療薬の探索・設計が可能になると期待されます。特に、SALが黄色ブドウ球菌の増殖に関与していることから既存の抗菌薬の効かないMRSA感染症※3や、黄色ブドウ球菌によって引き起こされるアトピー性皮膚炎などの治療薬の発展が期待されます。
なお、本研究は、日本医療研究開発機構(AMED)創薬等先端技術支援基盤プラットフォーム(BINDS)等の支援を受けて実施しました。
発表内容
研究の背景・先行研究における問題点
世界中の病院において、既存の抗菌薬が効かない細菌である「スーパーバグ」が確認され、その流行が危惧されています。MRSA(Methicillin-resistant Staphylococcus aureus)はスーパーバグの代表例で、各種の抗菌薬に抵抗性を示すため、MRSA感染症※3という院内感染が問題となっています。黄色ブドウ球菌(Staphylococcus aureus;以下、SA菌)は、化膿した傷口や皮膚表面に存在する常在菌で、けがの傷口から体内に侵入し、多くの病原因子を産生して種々の病気を引き起こします。多種多様な細菌が存在する皮膚表面でSA菌が異常に増えると、アトピー性皮膚炎が発症することがわかっています。SA菌が産生する病原因子の1つである「リパーゼ(SAL)」はSA菌の増殖と相関があり、免疫応答由来の殺菌効果を持つ脂質を分解し、菌の生存率を向上させて生体防御を破壊することがわかっています。このことからSAL阻害薬は抗MRSA薬の標的のみならずアトピー性皮膚炎の薬として注目されています。
そこで本研究では、より高い効果を持つ副作用の少ない新しい薬の探索・設計に貢献するため、これまで大型放射光施設「SPring-8」の強い放射光を用いたX線構造解析の経験を活かし、SALの立体構造の解明を試みました。
研究内容(具体的な手法等詳細)
研究を始めるにあたりSALの立体構造についての情報は全くありませんでした。またSALに対する阻害剤も活性の強い有効なものはありませんでした。そこで研究グループは、まずSALの阻害剤を探索し、抗肥満薬として海外で既に認可されているオルリスタット(図(a))という薬がSALに対して、2.4 µMというIC50値※5で阻害することを発見しました。オルリスタットの阻害活性は今までに知られていたSAL阻害剤のファルネソールより200倍以上強いことがわかりました。
本研究では、SALにこのオルリスタット分子が結合した複合体の立体構造を、X線結晶構造解析の手法を用いて原子レベルで解明するため、まず大腸菌でのSALの大量生産系を構築しました。純度の高いSALを精製し、SAL単体の結晶とオルリスタットと共に共結晶化した結晶を作成しました。X線回折実験およびデータ収集は、大型放射光施設「SPring-8」のビームラインBL41XUならびにBL44XUで行いました。
SALの立体構造は既存の他の細菌由来のリパーゼとよく似た3次元構造をとり、活性部位にフタをする役目を持ったLidドメインが開いた状態をとったオープン型コンフォメーションを取っていました(図(b))。オルリスタット分子はSALの活性部位である「鍵穴」に対して、「鍵」分子としてぴったりはまり込んでいることがわかりました(図(c))。またオルリスタットは比較的大きな分子で、SALの触媒残基である116番目のセリン残基の酸素原子と共有結合していました。そのほかの2つの部分はSALの比較的広い大きな活性部位のポケットに疎水性相互作用する形で存在していることがわかりました。これらの結合様式によって、オルリスタットはSALに対して高い選択的親和性を示すことが示唆されました。この成果によって、ドラッグデザインによる薬剤開発を進めるための基礎的知見が確立しました。
社会的意義・今後の予定
オルリスタットとSALの相互作用から、薬のデザインのための構造基盤が構築されました。MRSAはほとんどの抗菌薬に耐性があり、新生児や老人などの免疫力の弱い患者を死に至らしめることがわかっています。MRSAに対する抗菌薬以外の薬の探求は重要で、SALの阻害剤は、MRSA感染症への新規な作用機序の薬として期待されます。本研究の結果は、SALを標的としてMRSAや皮膚病などの疾患に対して、その構造情報を基にした創薬(Structure based drug design)も可能にすると期待できます。またオルリスタットは海外で既に認可されている薬であることから、ドラッグリポジショニング※6として、感染症への薬の適応の幅が広がることが期待できます。
発表雑誌
- 雑誌名
- Scientific Reports
- 論文タイトル
- Crystal structure of pathogenic Staphylococcus aureus lipase complex with the anti-obesity drug orlistat
- 著者
- Kengo Kitadokoro(北所 健悟), Mutsumi Tanaka(田中 睦美), Takaaki Hikima(引間 孝明), Yukiko Okuno(奥野 友紀子), Masaki Yamamoto(山本 雅貴) & Shigeki Kamitani(神谷 重樹)
- DOI番号
- 10.1038/s41598-020-62427-8
用語解説
- (注1)黄色ブドウ球菌(Staphylococcus aureus;SA菌)
- ヒトの鼻腔などに存在する常在菌で、化膿した傷口の膿の部分に多く存在し、感染症の原因となる多くの毒素タンパク質や酵素などの病原因子を産生します。病原性が強い菌で、基礎疾患のある人など、免疫力の低下した患者に対して、肺炎、敗血症、骨髄炎、関節炎などの重篤な感染症を引き起こします。
- (注2)オルリスタット
- 抗肥満薬として海外で認可済みの治療薬で、ヒトの脂肪分解酵素である胃や膵臓のリパーゼを不活性化し、脂肪吸収を阻害する効果があります。
- (注3)MRSA(Methicillin-resistant Staphylococcus aureus)感染症
- メチシリンなどのペニシリン剤やβラクタム剤など多くの抗生物質が効かない耐性を持った黄色ブドウ球菌によって引き起こされた感染症で、幼児や高齢者など免疫力が低下した患者が感染すると、多くの種類の抗菌薬が効かないために、治療が進まずに重症化し、死に至るケースがあります。
- (注4)X線構造解析
- タンパク質の立体構造を決定する手法で、ターゲットとなるタンパク質を結晶化し、大型放射光施設「SPring-8」などの強いビームを使って、X線照射して得られた回折データから、タンパク質の原子レベルでの立体構造を解析します。
- (注5)IC50値(half maximal(50%)inhibitory concentration;50%阻害濃度または半数阻害濃度)
- 化合物の生化学的な阻害作用の有効度合いを示す値です。数値が低いほど阻害が有効であることを表します。数値として示した濃度で薬物が、標的とする酵素の半数の働きを阻害できることを示しています。
- (注6)ドラッグリポジショニング(drug repositioning;既存薬再開発)
- 既にある疾患に有効な治療薬を、別の病気に対して有効性を見つけ出すことによって、別の疾患への治療薬として開発する方法です。既にヒトでの安全性や薬物動態が試験済みであることから、いくつかの試験を免除でき、薬剤の製造方法なども確立されている場合が多いので、新薬としての開発期間の大幅な短縮や研究開発コストを軽減することが可能となります。
お問い合わせ先
本リリースおよび研究内容に関するお問い合わせ先
北所 健悟(きたどころ けんご) 京都工芸繊維大学 分子化学系 准教授
〒606-8585 京都市左京区松ヶ崎橋上町1
TEL:075-724-7743 FAX:075-724-7743
E-mail:kengo"AT"kit.ac.jp
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課
TEL:03-6870-2219
E-mail:20-DDLSG-16"AT"amed.go.jp
※E-mailは上記アドレス"AT"の部分を@に変えてください。
掲載日 令和2年5月1日
最終更新日 令和2年5月1日


