筋肉の再生を促進し、萎縮を抑制する血中RNAを発見―筋肉のアンチエイジングや筋ジストロフィーの新規核酸医薬への応用へ―
成果情報
国立研究開発法人国立精神・神経医療研究センター(NCNP)
国立研究開発法人日本医療研究開発機構(AMED)
国立精神・神経医療研究センター(NCNP)神経研究所神経薬理研究部の北條浩彦室長の研究グループ※は、血液と共に循環する細胞外RNAの中から、筋肉の再生を促進し、または老化による筋肉の萎縮を抑制する細胞外マイクロRNA(1)199-3p(miR-199-3p)を発見しました。
体を巡る血液の中には、たくさんの種類の細胞外マイクロRNAが存在しています。研究グループは、若いマウスと年老いたマウスの血液中の細胞外マイクロRNAを解析し、若いマウスの血液に多く存在し年老いたマウスの血液では減少する細胞外マイクロRNAの中から、強い筋分化誘導能を持ったmiR-199-3pを発見しました。次に、そのマイクロRNAを人為的に供給できる模擬体、miR199#4合成核酸を設計し、マウスの筋損傷部や萎縮した老齢マウスの筋肉に投与すると、投与した筋線維の断面積が大きくなることがわかりました。さらに、筋ジストロフィー(2)のモデル動物であるmdxマウス(3)にmiR199#4を投与すると、投与したマウスの筋力が改善することを見出しました。
本研究で設計したmiR199#4は、筋損傷や加齢に伴う筋萎縮、例えばサルコペニア(4)、そして筋ジストロフィーの治療に応用できると考えられます。本研究の成果は、老化研究や老化関連疾患の研究開発そして難治性筋疾患の研究に貢献する新たな核酸分子を見出したといえます。
本研究の成果は、英国のオンライン科学雑誌「Communications Biology」(2021年3月29日付)に掲載されました。
- ※研究グループ:
- 国立精神・神経医療研究センター(NCNP)神経研究所
- 神経薬理研究部
- 室長 北條浩彦、流動研究員(研究当時)福岡聖之、リサーチフェロー 清水英雄、研究補助員 沼尾湖須生
- 疾病研究第4部
- 室長 関口正幸、研究補助員 藤田寛美、中村泰子
研究の背景
若いネズミと年老いたネズミの血管を外科的手術で結合して同じ血液循環系にするパラバイオーシスという実験があります。この実験結果は大変興味深く、若いネズミは老化が進み、年老いたネズミは若返りました。そして、体を巡る血液の中に老化促進やアンチエイジング効果をもった因子が存在することを示唆しました。
北條室長の研究グループは機能性RNAであるマイクロRNAについて長年研究を行ってきました。マイクロRNAは小さなRNAで様々な遺伝子の発現制御に関わっています。このマイクロRNAは細胞の中だけに存在するのではなく、細胞の外、例えば血液の中にも存在することが分かっています。そして、そのような細胞外のマイクロRNAと病気との関連も明らかになってきました。以上のような背景と現状そしてパラバイオーシスの実験結果から、研究グループは、若いマウスと年老いたマウスの血液の中に存在する細胞外マイクロRNAについて調べる研究を開始しました。
研究の概要・内容
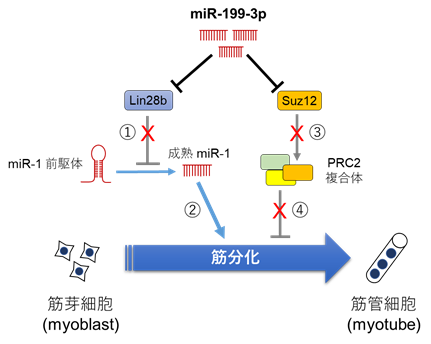
若いマウスと老齢マウスの血液の中に存在する細胞外マイクロRNAを網羅的に解析・比較した結果、多くのマイクロRNAが量的に変化することが示されました。そして、若いマウスの血液に多く存在し、年老いたマウスでは減少するマイクロRNAを調べたところ、筋肉だけもしくは筋肉に多く存在するマイクロRNAがその中に見つかりました。そこで、年老いたマウスの血液で少なくなるマイクロRNA(筋肉に多く存在するマイクロRNAも含めて)について、筋肉に分化する能力をもつマウスの筋芽細胞株(C2C12細胞)にそれらのマイクロRNAを導入して、C2C12細胞の筋分化に与える影響を調べました。その結果、今まで筋肉における働きがほとんど知られていなかったマイクロRNA199-3p(miR199-3p)に強い筋分化誘導能があることが分かりました。研究グループはこのmiR199-3pについてさらに詳しく解析し、そのマイクロRNAが作用する標的遺伝子として、Lin28b遺伝子とSuz12遺伝子を同定しました。そして、miR199-3pがLin28bとSuz12の発現を抑制することで、Lin28bとSuz12が持つ筋分化抑制機能が解除され、その結果、筋分化が進むことが分かりました(図1)。
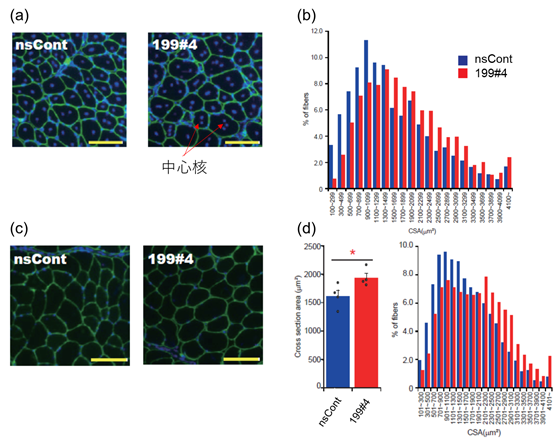
次に研究グループは、マウスをつかって生体内実験を行いました。筋肉を損傷したマウスの損傷部にmiR199#4合成核酸(miR199-3pを供給する模擬体)を投与し、再生する筋線維を観察しました。その結果、再生した筋線維の断面積が大きくなる(筋線維が太くなる)ことが観察されました(図2a、b)。次に、筋萎縮がありmiR199-3pが減少している老齢マウスの筋肉にmiR199#4を投与しました。その結果、miR199#4の投与によって筋線維が有意に太くなることが分かりました(図2c、d)。しかしながら、この老齢マウスの筋線維の肥大化は、上記再生筋線維の組織像とは異なることから(図2a、c)、新たな筋線維が生まれたというよりはすでに存在していた(萎縮した)筋線維がmiR199-3pによって肥大化したものであることが示唆されました。そこで、研究グループは、老齢筋線維の肥大化の背景にある分子メカニズムについて調べました。そして、萎縮した筋線維で働く重要な遺伝子、Atrogin1とMuRF1遺伝子の発現がmiR199#4の投与(すなわち、miR199-3pの供給)によって強く抑制されることを明らかにしました。したがって、老齢マウスの筋線維ではmiR199-3pの供給によって筋萎縮系遺伝子が抑制され、その結果、肥大化が起こったということがわかりました。
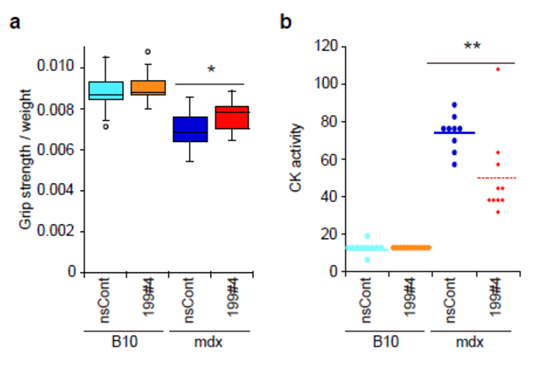
最後に研究グループは疾患モデル動物をつかった実験を行いました。筋ジストロフィーのモデル動物、mdxマウスにmir199#4を2回全身投与し、その後グリップテストを行って筋力の改善の有無を調べました。その結果、mir199#4を投与したmdxマウスは、コントロールrna(nscont)を投与したmdxマウスと比べて、有意な筋力の改善が認められました(図3a)。そして、筋ジストロフィーの血中で上昇するクレアチンキナーゼの活性もmir199#4投与によって改善する(有意に低下する)ことが観察されました(図3b)。以上の結果から、mir199#4、すなわちmir-199-3pがmdxマウスの症状改善に効果があることが示されました。最後に研究グループは疾患モデル動物をつかった実験を行いました。筋ジストロフィーのモデル動物、mdxマウスにmir199#4を2回全身投与し、その後グリップテストを行って筋力の改善の有無を調べました。その結果、mir199#4を投与したmdxマウスは、コントロールrna(nscont)を投与したmdxマウスと比べて、有意な筋力の改善が認められました(図3a)。そして、筋ジストロフィーの血中で上昇するクレアチンキナーゼの活性もmir199#4投与によって改善する(有意に低下する)ことが観察されました(図3b)。以上の結果から、mir199#4、すなわちmir-199-3pがmdxマウスの症状改善に効果があることが示されました。
今後の展望
今回の研究で、研究グループは血液と共に循環する細胞外マイクロRNAの中に加齢(老化)に伴って変化する細胞外マイクロRNAが存在することを明らかにしました。そして、その中から筋再生や筋萎縮抑制に効果のあるmiR-199-3pを発見しました。先に述べたパラバイオーシスの実験結果と照らし合わせてみると、miR-199-3pはアンチエイジング因子としての働きがあるかもしれないと考えられます。今回の成果は、老化や老化関連疾患及び難治性筋疾患の研究に貢献し、更には治療薬開発につながる細胞外マイクロRNAという新たな核酸分子を明らかにしたといえます。また、本研究で設計したmiR199#4は、筋損傷や加齢に伴う筋萎縮、例えばサルコペニア、そして筋ジストロフィーの治療に応用できると考えられます。研究グループは、その実用化に向けて研究開発を続けていきたいと考えています。
用語の説明
- (1)マイクロRNA(miRNA)
- 21~23塩基鎖長の機能性RNA。タンパク質をコードしないRNA遺伝子であり、ヒトゲノム上には数千のmiRNA遺伝子が同定されている。miRNAはRNA-induced silencing complex (RISC)の中に取込まれて遺伝子サイレンシングを仲介する働きをする。miRNAと完全または部分相補的な配列をもったメッセンジャーRNA(タンパク質をコードするRNA)を標的とし、その翻訳(タンパク質合成)を抑制することで遺伝子の発現を制御する。
- (2)筋ジストロフィー
- 筋力低下、筋萎縮を主要な症状とする遺伝性の筋疾患。最も多いデュシャンヌ型筋ジストロフィーは、X染色体にあるジストロフィン遺伝子の欠損が原因で発病する。
- (3)mdxマウス
- ジストロフィン遺伝子の突然変異によってジストロフィンを欠損したマウス。デュシャンヌ型筋ジストロフィーの代表的なモデル動物として広く用いられている。
- (4)サルコペニア
- 加齢によって骨格筋量が低下し、筋力や身体機能が低下する状態。詳細なメカニズムは不明。超高齢化社会に向けて対策が必要な病気の一つである。
原著論文情報
- 論文名
- MiR-199-3p enhances muscle regeneration and ameliorates aged muscle and muscular dystrophy
- 著者
- Masashi Fukuoka, Hiromi Fujita, Kosumo Numao, Yasuko Nakamura, Hideo Shimizu, Masayuki Sekiguchi, Hirohiko Hohjoh
- 掲載誌
- Communications Biology
- DOI
- 10.1038/s42003-021-01952-2
研究経費
本研究結果は、以下の日本医療研究開発機構「難治性疾患実用化研究事業」、日本学術振興会・科学研究費補助金、国立精神・神経医療研究センター精神・神経疾患研究開発費および三井住友海上福祉財団研究助成の支援を受けて行われました。
お問い合わせ先
研究に関するお問い合わせ】
国立研究開発法人国立精神・神経医療研究センター
神経薬理研究部 北條浩彦
〒187-8502 東京都小平市小川東町4-1-1
TEL:042-341-2711 内線5234、5951
Email:hohjohh”AT”ncnp.go.jp
報道に関するお問い合わせ
国立研究開発法人国立精神・神経医療研究センター
総務課 広報係
〒187-8551 東京都小平市小川東町4-1-1
TEL:042-341-2711(代表) FAX:042-344-6745
E-mail:ncnp-kouhou”AT”ncnp.go.jp
AMED事業に関するお問合せ
国立研究開発法人日本医療研究開発機構
創薬事業部 創薬企画・評価課
難治性疾患実用化研究事業
〒100-0004 東京都千代田区大手町1-7-1読売新聞ビル
TEL:03-6870-2226
E-mail:nambyo-r”AT”amed.go.jp
※E-mailは上記アドレス”AT”の部分を@に変えてご使用ください。
関連リンク
掲載日 令和3年4月13日
最終更新日 令和3年4月13日


