成果情報 Reelinの前頭前皮質内微量投与はMK-801誘発性認知記憶障害を改善する
成果情報
国立大学法人東海国立大学機構名古屋大学
国立研究開発法人日本医療研究開発機構
国立大学法人東海国立大学機構名古屋大学大学院医学系研究科医療薬学の澤幡雅仁特任助教(現富山大学助教)、永井拓准教授(現藤田医科大学教授)、山田清文教授、藤田医科大学大学院保健学研究科の鍋島俊隆客員教授、名古屋市立大学大学院薬学研究科病態生化学の服部光治教授らの研究グループは、統合失調症モデルマウスを使ってReelinの認知記憶改善作用に前頭前皮質が重要であること、そのメカニズムとして過剰な神経活動を抑制する可能性を明らかにしました。
Reelinは分泌性糖タンパク質であり、正常な脳形成、神経可塑性や認知機能に関与することが知られています。一方、Reelin遺伝子変異や発現量低下によるReelinの機能低下が統合失調症の発症や病態形成に関与すること、反対にReelinを投与するなどして機能増強すると、統合失調症モデルマウスの行動障害が改善されることなどが報告されていますが、そのメカニズムについてはよくわかっていませんでした。
本研究では、統合失調症において重要と考えられている前頭前皮質に着目し、統合失調症モデルマウスの前頭前皮質にReelinを微量投与し、行動学的、免疫組織学的解析を行いました。
今後の展開としては、Reelinシグナル伝達経路に焦点をあて、特にADAMTS-3などのReelin分解酵素の阻害剤を開発し統合失調症治療の創薬に繋げたいと考えています。
本研究は日本医療研究開発機構(AMED)脳科学研究戦略推進プログラム(発達障害・統合失調症等の克服に関する研究)、「大規模データ探索型」双方向トランスレーショナル研究を基軸にする疾患横断的な精神・神経疾患研究(精神疾患領域)の支援を受けて実施されました。
ポイント
- Reelinの認知記憶改善作用に前頭前皮質が重要であることを示した。
- Reelinの認知記憶改善作用には、Reelin受容体と結合し、そのシグナルが伝達することが重要であると示した。
- Reelinの認知記憶改善作用のメカニズムとして、過剰な神経活動興奮を抑制する可能性を示した。
- Reelinシグナル伝達経路は、これまでの統合失調症治療薬の作用機序とは全く異なるため、新たな治療標的として期待される。
背景
統合失調症は幻覚、妄想などの陽性症状、意欲の低下などの陰性症状、認知機能障害を主症状とし、罹患率は約1%と頻度の高い精神疾患です。現在、治療に用いられている抗精神病薬は、主にドパミンやセロトニンなどの神経伝達物質の受容体を遮断することにより効果を発揮します。しかし、錐体外路症状などの重篤な副作用の発現や治療抵抗性などの問題から、作用機序の異なる治療薬の創製が期待されています。Reelinは分泌性糖タンパク質であり、発達期においては正常な脳形成、成熟期では神経可塑性や認知機能に関与することが知られています。また、統合失調症患者の遺伝子解析などにより、Reelin遺伝子の変異あるいはmRNAやタンパク質レベルでのReelin発現量の低下が見られることからReelinの機能低下と統合失調症病態との関連性が考えられていました。また、Reelinタンパク質をマウスの脳室内に微量注入することで統合失調症モデルマウスの認知機能障害などが改善することが報告されていますが、そのメカニズムについては不明であり、Reelinシグナルを標的とした統合失調症の新規治療法開発における課題の1つでした。
研究成果
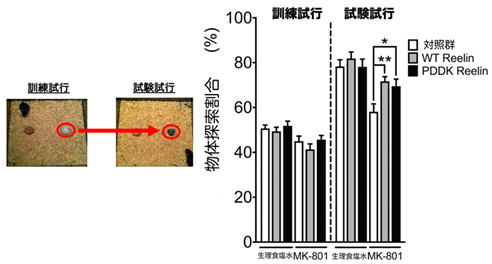
前頭前皮質は統合失調症患者で病的な変化が見られる脳領域であり、病態との関連が強く示唆されています。そこで本研究では、統合失調症のグルタミン酸仮説に基づき、グルタミン酸受容体の非競合的拮抗薬であるMK-801*1を処置した統合失調症モデルマウスの前頭前皮質にReelinタンパク質を微量注入し、行動学的解析を行いました(図1)。新奇物体認識試験*2を行った結果、前頭前皮質へのReelinタンパク質の微量注入により、統合失調症モデルマウスの新奇物体認識の障害が有意に改善しました(図2)。一方で、プレパルス抑制試験*3、Y字迷路試験*4では変化はありませんでした。我々を含むいくつかの研究グループの過去の報告からReelinの脳室内投与により認知機能、感覚情報処理能力障害が改善することが示唆されています。今回の結果は前頭前皮質への局所投与によるものであることから、Reelinの認知記憶改善作用において、前頭前皮質が重要であり、感覚情報処理能力や作業記憶の改善には前頭前皮質以外の脳領域も重要であることを示していると考えられます。また、ReelinはADAMTS-3などの分解酵素により失活することが報告されているため、分解抵抗性のReelin(PDDK変異体)の効果も同時に調べましたが、その効果は野生型Reelinと同程度でした。Reelinは受容体と結合し、下流のDab1タンパクのリン酸化、分解を伴って、シグナルが伝達されます。Reelin刺激により、Dab1タンパクの発現量が一過性に低下しますが、PDDK変異体注入では、Dab1タンパク質の発現量が大幅に低下するため、Reelinシグナルに対しネガティブフィードバック機構が働き、その結果、Reelinの分解を阻害することによって得られると期待していた程の効果が得られず、野生型Reelin注入と同程度の効果になったと考えられます。
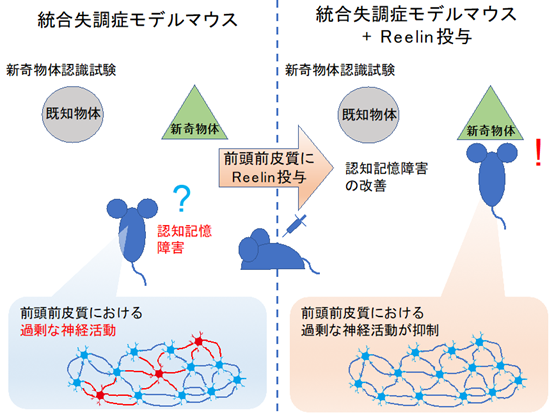
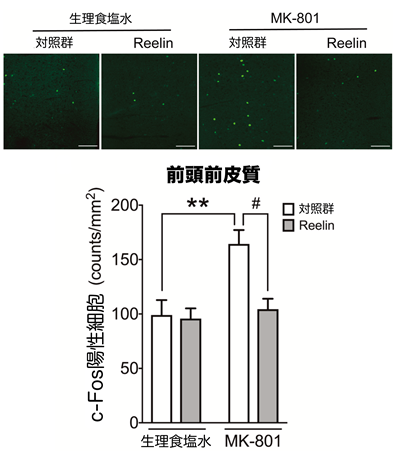
次に、Reelinの認知記憶障害改善作用のメカニズムを調べるため、c-Fosタンパク質*5の免疫組織学的解析を行いました。統合失調症モデルマウスの前頭前皮質では、コントロールマウスに比較してc-Fos陽性細胞の数が有意に増加しましたが、その増加はReelinタンパク質の微量注入で有意に抑制され、統合失調症により生じた過剰な神経活動興奮が抑制されていることが示されました(図3)。
最後に、Reelinの認知記憶障害改善作用がReelin受容体を介したものであるかどうかを調べるため、Reelin受容体への結合能が失われたReelin変異体タンパク質(K2360/2467A変異体)を前頭前皮質内に微量注入し、新奇物体認識試験を行いました。その結果、野生型Reelinでは認知記憶障害改善作用が見られましたが、K2360/2467A変異体では改善作用は見られませんでした。
以上のことから、統合失調症モデルマウスにおけるReelinの認知記憶障害改善作用には、①前頭前皮質が重要であること、②そのメカニズムとして、ReelinがReelin受容体に結合し、③過剰な神経活動興奮を抑制する可能性を明らかにしました。
今後の展開
Reelinは分子量が非常に大きいタンパク質であるため、Reelinタンパク質そのものを末梢から投与しても、血液脳関門を通過できず、中枢に移行することは難しいと考えられます。しかし、今回の研究でReelinシグナル伝達経路が統合失調症の症状改善に重要であることが改めて示されたことから、内因性のReelin分解酵素を阻害することにより、統合失調症にて減衰すると考えられるReelinシグナル伝達を回復させることを期待して、ADAMTS-3などのReelin分解酵素の阻害剤を開発し、統合失調症の治療に繋げたいと考えています。
用語説明
- ※1 MK-801
- 非競合的NMDA受容体遮断薬で、マウスに投与することで認知機能やプレパルス抑制の障害が見られ、統合失調症モデルマウスの作製に使用されます。
- ※2 新奇物体認識試験
- マウスが既知物体よりも新奇物体に強い関心を示す性質を利用した認知記憶を調べる試験です。訓練試行で2つの物体を認知・記憶させた後、試験試行では片方を新規物体に置換し、探索行動を計測します。認知記憶障害が起きると既知物体と新奇物体の識別能が低下し、両物体に対して同程度の関心を示します。
- ※3 プレパルス抑制試験
- 感覚情報処理能力を調べる試験で、統合失調症患者ではしばしばこの能力が低下しています。驚愕反応を起こす大きな音の前に少し小さな音を聞かせると本来の驚愕反応が抑制されます。これをプレパルス抑制と呼びます。
- ※4 Y字迷路試験
- 新奇物体認識試験と同様にマウスが新しいもの・場所を好む性質を利用した試験で、作業記憶を調べる試験です。作業記憶とは行動やもの、場所などの情報を一時的に保存するための記憶です。Y字状の迷路をマウスに自由に探索させ、新しいアーム(場所)を継続して探索する行動を交代行動とし、作業記憶の指標として評価します。
- ※5 c-Fosタンパク質
- 神経活動の活性化を示すマーカーとして使用される。神経活動が亢進すると、c-Fosタンパク質の発現が誘導されるため、c-Fos陽性細胞の増加は、活性化した神経細胞が増加していることを示しています。
発表雑誌
- 掲雑誌名
- Pharmacological Research
- 論文タイトル
- Microinjection of Reelin into the mPFC prevents MK-801-induced recognition memory impairment in mice
- 著者・所属
- 澤幡雅仁・名古屋大学大学院医学系研究科・医療薬学、富山大学学術研究部薬学・和漢系・応用薬理学
浅野裕樹・名古屋大学医学部
永井拓・名古屋大学大学院医学系研究科・医療薬学、藤田医科大学精神・神経病態解明センター
伊藤教道・名古屋大学大学院医学系研究科・医療薬学
河野孝夫・名古屋市立大学大学院薬学研究科・病態生化学
鍋島俊隆・藤田医科大学大学院保健学研究科先端診断システム探索部門
服部光治・名古屋市立大学大学院薬学研究科・病態生化学
山田清文・名古屋大学大学院医学系研究科・医療薬学 - DOI
- 10.1016/j.phrs.2021.105832
- English ver.
- Microinjection of Reelin into the mPFC prevents MK-801-induced recognition memory impairment in mice(Research Topics | Nagoya University GraduateSchool of Medicine)
お問い合わせ先
研究について
国立大学法人東海国立大学機構名古屋大学医学部・医学系研究科医療薬学教授
名古屋大学医学部附属病院薬剤部部長
山田清文
TEL:052-744-2674 FAX:052-744-2979
E-mail:kyamada“AT”med.nagoya-u.ac.jp
広報担当
国立大学法人東海国立大学機構名古屋大学医学部・医学系研究科総務課総務係
TEL:052-744-2228 FAX:052-744-2785
E-mail:iga-sous“AT”adm.nagoya-u.ac.jp
AMED事業関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課/脳科学研究戦略推進プログラム
TEL:03-6870-2286 FAX:03-6870-2243
E-mail:brain-pro“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和3年10月29日
最終更新日 令和3年10月29日


