成果情報 リンパ腫における新規発がんメカニズムを発見―脂質を軸とした新たな治療法の開発に期待―
成果情報
東京大学
東海大学
科学技術振興機構
日本医療研究開発機構
発表者
村上 誠(東京大学 大学院医学系研究科 疾患生命工学センター 教授)
幸谷 愛(東海大学 医学部 基礎診療学系先端医療科学 教授)
発表のポイント
- リンパ腫では、「細胞外小胞(Extracellular Vesicles: EV)」注1)を介した腫瘍と腫瘍微小環境注2)での相互作用により腫瘍形成が促進されますが、その詳細は不明でした。
- 腫瘍微小環境において、腫瘍由来EVはリン脂質注3)分解酵素「sPLA2」により分解され、その分解産物である脂質が腫瘍形成を促進するという新規メカニズムが明らかになりました。
- リンパ腫の発生および悪性化につながる「sPLA2-EV軸」という、新たな免疫チェックポイントをターゲットとした新規治療法の開発が期待できます。
研究の概要
科学技術振興機構(JST)「戦略的創造研究推進事業」および日本医療研究開発機構(AMED)「次世代がん医療創生研究事業」などにおいて、東海大学 医学部の幸谷愛教授および東京大学 大学院医学系研究科の村上誠教授は、東海大学 大学院医学研究科の工藤海大学院生、東京大学大学院医学系研究科の三木寿美研究員らとともに、リンパ腫の発生や悪性化における細胞外小胞(EV)の新規作動メカニズムを発見しました。
東海大学 幸谷グループでは、これまでにEpstein-Barrウイルス(EBV)注4)陽性B細胞性悪性リンパ腫の発症におけるEVの役割を調査してきましたが、その作動メカニズムの全容は明らかになっていませんでした。一方、東京大学 村上グループでは、これまでに細胞外環境に存在するリン脂質分解酵素「分泌型ホスホリパーゼA2(sPLA2)注5)」が関与する数多くの生命現象を明らかにしてきましたが、実際にsPLA2が細胞外で基質としているリン脂質の供給源は不明でした。
本研究では、悪性リンパ腫組織中の腫瘍随伴マクロファージ(TAM)注6)から分泌されるsPLA2が腫瘍細胞由来EVのリン脂質を分解することを証明しました。さらに、この分解により「細胞への取り込まれやすさ」や「免疫抑制効果」などのEVの機能が飛躍的に向上し、さまざまな生命現象が誘導されることが分かりました。このとき、EVリン脂質の分解産物であるリゾリン脂質などが細胞にシグナルを伝達しているという、これまでのEV生物学にはない新規作動メカニズムを介することを発見しました。そして本研究グループは、ヒトにおけるリンパ腫発生を再現したモデルマウスを使って、sPLA2によるEV分解が腫瘍形成において必要不可欠であることを証明しました。また実際のヒト患者検体の解析からも、sPLA2が腫瘍形成と悪性化に関わることを示しました。
一方で、本研究ではリンパ腫由来EVのみならず他のがん細胞由来EVもsPLA2により分解されることを証明し、sPLA2-EV軸は腫瘍形成において、共通の現象であることを明らかにしました。今後はこのsPLA2-EV軸が新たな「免疫チェックポイント」として、がん治療のための新しい薬物標的となることが期待されます。また、本研究で証明されたsPLA2によるEV機能の増強効果から、「組織保護・抗炎症作用を持つEV」などのさまざまな種類のEVが持つ固有の能力をsPLA2が増強するのではないかという、これまでに幸谷グループで報告した仮説の検証も現在行っており、今後は治療的応用への発展も期待されます。
本研究成果は、2022年3月16日午前0時(日本時間)に米国科学誌「Cell Metabolism」のオンライン版で公開されました。
発表内容
研究の背景と経緯
がんの発症や悪性化には、炎症の制御が深く関与しています。中でも炎症反応が長引くことで構築される腫瘍微小環境は、腫瘍形成において極めて重要な役割を担うと考えられています。東海大学 幸谷グループでは、これまでにEBV陽性B細胞性悪性リンパ腫の発症に関する研究から、ウイルス由来遺伝物質を運ぶEVがリンパ腫悪性化のカギであることを証明してきました[Higuchi et al. Blood, 2018; 131 (23)]。しかし、そのウイルス由来遺伝物質のみでは悪性化が誘導されないことから、EVを構成するリン脂質に着目し、その分子内には抗炎症性脂質であるドコサヘキサエン酸(DHA)などの多価不飽和脂肪酸(PUFA)が多く含まれるということを明らかにしました。PUFAは機能性脂質「脂質メディエーター注7)」の前駆体であり、通常はリン脂質に結合した状態で存在しますが、「ホスホリパーゼA2(PLA2)」がこれをリン脂質から切り離すことで脂質メディエーター合成を開始させることが知られています。
一方で近年、炎症やがんにおいては脂質メディエーターの関与が大きいことが知られており、さまざまな疾患へのsPLA2群の関与が注目されています。そこで「sPLA2がEV膜上リン脂質に作用することで脂質メディエーターが生成され、腫瘍微小環境に多大な影響を及ぼしている」との仮説を立て、sPLA2研究で国内随一の実績を持つ東京大学 村上グループとの共同研究を行いました。EVを介した物質の輸送に関しては世界中で多くの研究が報告されていますが、その実験系構築の難しさや脂質という領域の複雑さから、EVの膜脂質に着目した研究はごくわずかです。そのような中で、本研究グループは上記の仮説をもとに、「実際に腫瘍由来EVがsPLA2の基質となり得るのか」を皮切りに、両研究グループの強みを生かして、詳細な脂質解析、その生物学的意義および腫瘍形成に及ぼす影響について検討を進めました。
研究の内容
本研究では、まず血中の免疫細胞をヒトの細胞に置き換えたヒト化マウス注8)を作成し、EBVを感染させることでマウスにヒトのリンパ腫を自然発生させました。幸谷グループの属する東海大学では、このヒト化マウスモデルを国内最初に作成した実績があり、安定的に作成できました。この腫瘍モデルマウスの腫瘍組織内で発現するsPLA2を解析したところ、sPLA2群の中でも強力な活性を持つ「sPLA2-X」が腫瘍随伴マクロファージ(TAM)に高発現していることが明らかとなりました(図1)。
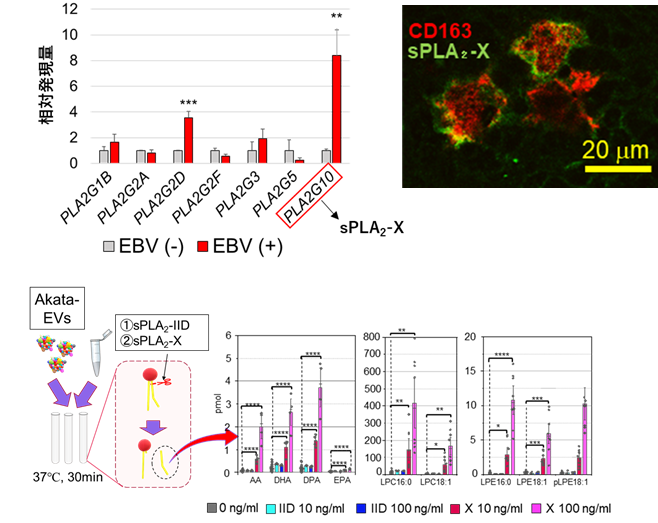
発現増加が見られたsPLA2をEBV陽性リンパ腫細胞から分泌されたEV(Akata EVs)と試験管内で反応させ、質量分析装置にてリン脂質分解産物を検出した。その結果、sPLA2-Xと反応させた場合に分解産物の検出量が増加し、EVが分解されていることが証明された。しかし対照実験のsPLA2-IIDではそのような変化は見られず、少なくともこの条件下では酵素活性を示さなかった(下段図)。
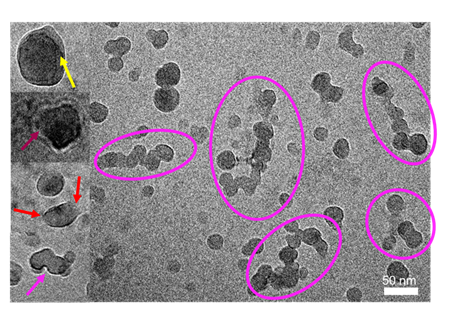
そこでそのsPLA2-Xと腫瘍由来EVを試験管内で反応させたところ、大量のリン脂質分解産物が検出され、腫瘍由来EVがsPLA2に分解されることが証明されました(図1)。またこのときのEVを「クライオ電子顕微鏡」で観察したところ、この反応によりEVの形状が著しく変化することが観察されました(図2)。
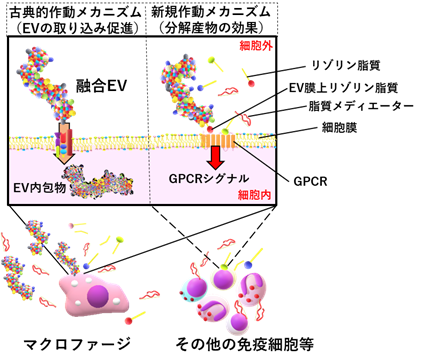
次にそのsPLA2処理EV(sPLA2 EV)の機能についてさまざまな側面からの解析を行いました。その結果、
①EVの古典的作動メカニズムであるマクロファージへの取り込みが促進される
②マクロファージにおけるTAMマーカー発現が著しく増加する
③酵素反応によりEVから生成される脂質メディエーター分子そのものも①・②の機能を促進する
④sPLA2の酵素反応は腫瘍細胞由来・患者血清由来のEVで起こり、健常者血清由来のEVでは影響が小さいことを含むさまざまな現象が明らかとなりました。
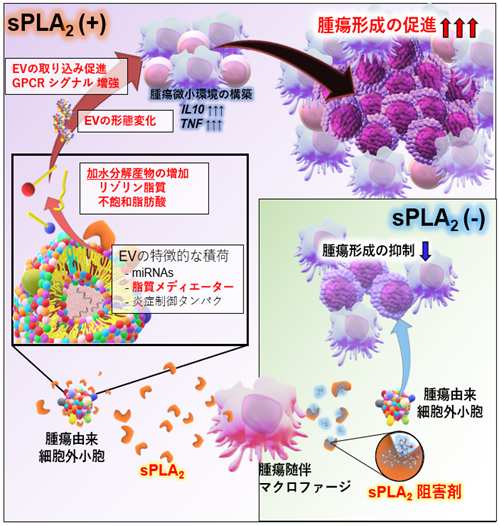
一方で、この酵素反応により生成される脂質メディエーターは細胞膜上の「Gタンパク質共役受容体(GPCR)注9)」を活性化することで効果を発揮することが知られています。sPLA2 EVでは上記の知見から、脂質メディエーターによるGPCRの活性化の可能性が考えられたため、東北大学井上 飛鳥准教授、東京大学 青木 淳賢教授が開発した「TGFα Shedding Assay[Inoue et al, Nature Methods, 2019; 9]」を用いて解析を行ったところ、EVを取り込む能力のある単球様細胞株THP-1だけでなくEVを取り込む能力の無いTリンパ球系細胞株であるJurkatでもsPLA2 EVによるシグナル増強が確認されました。これは「EVは細胞に取り込まれずとも作用する」という、これまでのEV生物学にはない新規の作動メカニズムが存在することを意味しており、これにより生体内ではsPLA2によってEVのターゲット層が大幅に拡大し、さまざまな細胞に影響し得ると考えられます(図3)。
次に本研究グループは、そのsPLA2 EVの効果を生体において実証するため、炎症モデルマウスにsPLA2 EVを投与することで、リンパ腫由来EVが本来持っている抗炎症・免疫抑制効果が、sPLA2によって増強されるかを検討しました。その結果、脾臓や肺におけるさまざまな抗炎症効果の増強が認められました(図4)。
さらに本研究グループはEBV感染腫瘍形成モデルでの検討も行いました。前述の先行研究において、腫瘍由来EVを投与すると腫瘍形成が促進されるということが報告されていましたが、本研究では通常の腫瘍由来EVではなくsPLA2 EVを投与したところ、劇的な腫瘍形成促進効果が確認されました(図4)。また、生体内に存在するsPLA2を阻害剤によって抑制すると腫瘍形成が完全に抑制されました。
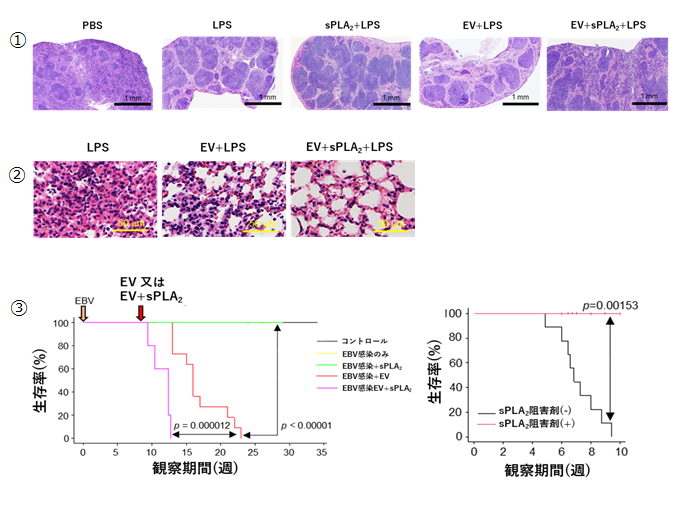
次にそのsPLA2 EVを、造血系ヒト化マウスを用いたEBV陽性リンパ腫モデルに投与した時の腫瘍形成促進効果(③)とsPLA2阻害時の腫瘍形成への影響(④)を評価した。腫瘍形成促進効果を評価する際には、低力価の感染では腫瘍形成を引き起こさないEBV株であるB95-8株を感染させ、そこへsPLA2 EVなどを投与した。このときEV投与により腫瘍形成は見られたものの、sPLA2 EV投与時にはそれよりも急速に腫瘍が形成された。一方で腫瘍組織におけるsPLA2阻害効果を評価する際には、感染のみで腫瘍形成を引き起こすEBV株であるAkata株を感染させた。このときsPLA2阻害剤はウイルス感染時より浸透圧ポンプを体内に留置することで観察している間持続的に投与した。この結果sPLA2阻害により腫瘍形成が完全に抑制された。
最後にこの現象が実際にヒトでも起こっているのか検討するために、東海大学医学部付属病院で過去にびまん性大細胞型B細胞リンパ腫注10)と診断された患者の腫瘍組織検体全100例を用いてヒト腫瘍組織におけるsPLA2の発現の有無を調査しました。その結果、sPLA2-X陽性の患者では、悪性度の指標となるバイオマーカーが陰性群より高値を示し、臨床病期も高い傾向が見られ、予後も不良であることが明らかとなりました。
以上の結果をまとめると、腫瘍形成においては腫瘍組織中のTAMより細胞外リン脂質分解酵素sPLA2が分泌されており、これにより腫瘍細胞から分泌されたEVの膜リン脂質が分解されると、さまざまな脂肪酸やリゾリン脂質が生成され、EVの形態変化・GPCRシグナル増強・取り込みの促進などが誘導され、結果的には腫瘍微小環境の構築が急激に促進され腫瘍形成へとつながることが明らかになりました。一方でこのsPLA2-EV軸を阻害するsPLA2阻害剤の投与で腫瘍形成が抑制されたことから、がん治療の新規創薬ターゲットとなることが期待されます(図5)。
今後の展開
本研究から、悪性リンパ腫の発生よび悪化におけるカギ「sPLA2-EV軸」という新たな免疫チェックポイントの存在が明らかになったことより、今後はリンパ腫組織中のsPLA2をターゲットとしたリンパ腫治療薬の開発やバイオマーカーとしての活用などが望まれます。また、EV膜リン脂質の分解は、他のがん由来のEVにおいても起こることが証明されたことから、sPLA2-EV軸をターゲットとした治療は全がんにおいて有効である可能性も秘めており、今後のさらなる研究が期待されます。
一方でsPLA2 が示したEVの機能向上効果を治療目的に応用する試みも進められており、幸谷グループでは組織保護作用・抗炎症作用を持つヒト肝細胞由来のEVにおいてsPLA2がその組織保護・抗炎症効果を飛躍的に向上させることを確認しています。このようにsPLA2-EV軸は腫瘍形成の枠にとどまらず、sPLA2がEVの固有の能力を増強するという点でこの特殊なsPLA2-EV代謝物を「sPLA2 Reacted EV Derivatives;SPREDs」と名付け(特許出願中)、現在は新型コロナウイルス感染症を模した重症肺炎モデルにおける治療効果に重点を置いた検討が進められています。最終的には、SPREDsを用いた、全身性に有効な抗炎症薬の開発につながることが期待されます。
研究体制と支援について
本成果は、以下の事業・研究領域・研究課題によって得られました。
- 科学技術振興機構 (JST) 戦略的創造研究推進事業(CREST)チーム型研究
- 研究領域:「細胞外微粒子に起因する生命現象の解明とその制御に向けた基盤技術の創出」
(研究総括:馬場 嘉信(名古屋大学 大学院工学研究科 教授)
研究課題名:「細胞外微粒子の1粒子解析技術の開発を基盤とした高次生命科学の新展開」
研究代表者:渡邉 力也(理化学研究所 主任研究員)
研究分担者:幸谷 愛(東海大学 医学部 基盤診療学系先端医療科学 教授)
研究期間:2017年10月~2024年3月 - 日本医療研究開発機構 (AMED) 次世代がん医療創生研究事業(P-CREATE)
- 研究課題名:「細胞外脂質代謝酵素によるエクソソームの脂質修飾を介したがん微小環境の制御」
研究代表者:村上 誠(東京大学 大学院医学系研究科 疾患生命工学センター 教授)
研究分担者:幸谷 愛(東海大学 医学部 基盤診療学系先端医療科学 教授)
研究期間:2020年度~2021年度 - AMED革新的先端研究開発支援事業 ユニットタイプ(AMED-CREST)
- 研究開発領域:「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」
(研究開発総括:吉村昭彦 慶應義塾大学 医学部 教授)
研究課題名:「疾患脂質代謝に基づく生体組織の適応・修復機構の新基軸の創成と医療技術シーズの創出」
研究代表者:村上 誠(東京大学 大学院医学系研究科 疾患生命工学センター 教授)
研究期間:2020年~2025年度 - JSPS 挑戦的研究(萌芽)
- 研究課題名:「分泌性PLA2による新しいエクソソームバイオロジーの構築」
研究代表者:幸谷愛(東海大学 医学部 基盤診療学系先端医療科学 教授)
研究期間:2020年~2021年度
本研究成果は、東海大学血液腫瘍内科の安藤潔教授、東海大学病理診断学の中村直哉教授、Joaquim Carrelus講師、東北大学の井上飛鳥准教授、徳島大学の山本圭准教授、Massachusetts General Hospital/Harvard Medical Schoolの樋口廣士研究員、滋賀医科大学の森田真也教授、東京大学の青木淳賢教授らを含む複数機関との共同研究によって得られました。
論文情報
- 論文タイトル
- Secreted phospholipase A2 modifies extracellular vesicles and accelerates B-cell lymphoma
(分泌性ホスホリパーゼA2は細胞外小胞を修飾しB細胞リンパ腫形成を促進する) - 著者名
- Kai Kudo, Yoshimi Miki, Joaquim Carreras, Shunya Nakayama, Yasushi Nakamoto, Masatoshi Ito, Etsuko Nagashima, Kei Yamamoto, Hiroshi Higuchi, Shin-ya Morita, Asuka Inoue, Junken Aoki, Kiyoshi Ando, Naoya Nakamura, Makoto Murakami, Ai Kotani
- 工藤 海1,2#、三木 寿美3、Joaquim Carreras 4、中山 駿矢1,2,5、中本 泰1,2、伊藤 誠敏6、 長島 悦子1,2、 山本 圭7、 樋口 廣士8、 森田 真也9、 井上 飛鳥10、 青木 淳賢11、 安藤 潔5、 中村 直哉4、村上 誠3*、 幸谷 愛1,2*(#:筆頭著者、*:責任著者)
- 所属
-
- 東海大学医学部 基盤診療学系 先端医療科学
- 東海大学総合医学研究所 血液・腫瘍学研究部門
- 東京大学大学院 医学系研究科 疾患生命工学センター 健康環境医工学部門
- 東海大学医学部 病理診断学
- 東海大学医学部 血液腫瘍内科
- 東海大学メディカルサイエンスカレッジオフィス
- 徳島大学大学院社会産業理工学研究部 生物資源産業学域 生体分子機能学分野
- Center for Cancer Immunology, Cutaneous Biology Research Center, Center for Cancer Research, Massachusetts General Hospital, Harvard Medical School
- 滋賀医科大学医学部附属病院 薬剤部
- 東北大学 大学院薬学研究科・薬学部 生命薬科学専攻 生命解析学講座 分子細胞生化学分野
- 東京大学大学院薬学系研究科 薬科学専攻 生物薬科学講座
- 雑誌名
- Cell Metabolism
- DOI
- 10.1016/j.cmet.2022.02.011.
- 公表日
- 2022年3月16日午前0時(日本時間)
用語解説
- 注1)細胞外小胞(Extracellular vesicle; EV)
- 細胞から放出される核を持たない脂質2重膜で囲まれた粒子。がん研究の分野では、EVがさまざまなタンパク質や核酸を輸送することで、がんの生存や悪性化を促す働きが注目を集めている。
- 注2)腫瘍微小環境
- がん細胞(腫瘍)の周囲を囲む環境のこと。正常組織や免疫細胞、細胞外マトリックス、血管などから構成される。微小環境から腫瘍が栄養の供給を受けるなど、腫瘍と微小環境は相互に影響を及ぼし合っており、微小環境が腫瘍の縮小や増殖にも影響を及ぼすと考えられている。
- 注3)リン脂質
- コリンやセリンなどの親水性の分子と疎水性を示す2本の脂肪酸を持つ両親媒性の脂質。細胞膜や細胞外小胞の膜などの生体膜の主要な構成成分として知られている。また親水性分子の種類と2本の脂肪酸の種類からその組み合わせは無数にあり、膨大な数の分子種が存在することが明らかになっている。
- 注4)Epstein-Barrウイルス(EBV)
- 2本鎖DNAをゲノムとして持つヘルペスウイルスの一種。EBV関連疾患の多くは悪性リンパ腫などの血液腫瘍だが、まれに胃がんなどの上皮細胞がんも引き起こすことが知られている。本研究課題では腫瘍形成能の強いAkata株とそれに比べて弱いB95-8株の2種類のウイルス株を用いた。
- 注5)分泌型ホスホリパーゼA2(sPLA2)
- リン脂質に結合する2本の脂肪酸のうち、sn-2位と呼ばれる部位には不飽和脂肪酸を結合していることが多いが、sPLA2はその部分を切断し、リン脂質から脂肪酸とリゾリン脂質を遊離する酵素の一種である。遊離された脂肪酸とリゾリン脂質は強力な脂質メディエーターへと変換されることが知られていることから、sPLA2は脂質メディエーター合成の律速因子であるとされている。生体においてsPLA2はリンパ組織におけるオメガ(ω)-3脂肪酸の遊離を介した獲得免疫へのブレーキや(sPLA2-IID)、気道上皮における自然免疫リンパ球ILC2の活性化促進によるぜんそくの悪化(sPLA2-X)など、それぞれ異なる組織分布と基質選択性を示すことで組織固有の生命応答を引き起こすことが知られている。
- 注6)腫瘍随伴マクロファージ(TAM)
- マクロファージとは、体の中に侵入してきたウイルスや細菌など異物の排除に関与する重要な免疫細胞の1つであり、腫瘍随伴マクロファージは、腫瘍組織に浸潤しているマクロファージの総称。主に免疫抑制型の形質を示すM2型マクロファージがこれに含まれる。そのため、この細胞の浸潤した腫瘍組織では正常な抗腫瘍免疫が抑制され、腫瘍の進展が促進されることが知られている。
- 注7)脂質メディエーター
- 不飽和脂肪酸やリゾリン脂質から派生する機能性脂質で、生理活性脂質とも呼ばれる。一般的にはプロスタグランジンやロイコトリエンなどが有名であり、生体内においては炎症を促進する効果を持つω-6系脂肪酸(アラキドン酸など)に由来する脂質メディエーターと、反対に炎症を鎮める効果を持つω-3系脂肪酸(ドコサヘキサエン酸など)が互いに拮抗(きっこう)することで、正常な生命活動のバランスが保たれている。一方、リゾリン脂質性の脂質メディエーターとしてはリゾホスファチジン酸(LPA)が知られている。脂質メディエーターのほとんどはGPCRを介してシグナルを伝達する。
- 注8)ヒト化マウス
- 重症免疫不全マウス(NOD/shi-scid, IL-2Rγ KOマウス)にヒト臍帯(さいたい)血由来の造血幹細胞を移植したマウス。マウス生体内に生着したヒト造血幹細胞からヒトの血液細胞が再構築されるため、ヒトの造血研究などで有用なツールとして用いられている。
- 注9)Gタンパク質共役受容体(GPCR)
- 細胞膜上に存在する膜貫通型の受容体で、その種類は数百種類にもおよぶ。現在出回っている薬剤の多くがこのGPCRを介して機能することが知られており、創薬における重要な標的分子であるとされている。
- 注10)びまん性大細胞型B細胞リンパ腫(DLBCL)
- B細胞性悪性リンパ腫の一種。日本においては最も頻度の高い悪性リンパ腫であり、リンパ腫全体のおよそ30パーセント程度を占めることが知られている。
お問い合わせ先
本研究に関する問い合わせ先
村上 誠(むらかみ まこと)
東京大学 大学院医学系研究科 疾患生命工学センター 教授
〒113-8655 東京都文京区本郷7-3-1
TEL:03-5841-1431
E-mail:makmurak”AT”m.u-tokyo.ac.jp
幸谷 愛(こうたに あい)
東海大学 医学部 基盤診療学系 先端医療科学 教授
〒259-1193 神奈川県伊勢原市下糟屋143
TEL:0463-93-1121 (内線2781)
E-mail:aikotani”AT”k-lab.jp
報道に関するお問い合わせ
東海大学 広報担当 喜友名 浩史(キユナ ヒロシ)
〒259-1292 神奈川県平塚市北金目4-1-1
TEL:0463-58-1211(代表)
E-mail:pr”AT”tsc.u-tokai.ac.jp
東京大学 医学部・医学系研究科総務チーム
〒113-0033 東京都文京区本郷7-3-1
TEL:03-5841-3304 FAX:03-5841-8585
E-mail:ishomu”AT”m.u-tokyo.ac.jp
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
TEL:03-5214-8404 FAX:03-5214-8432
E-mail:jstkoho”AT”jst.go.jp
JST事業に関する問い合わせ
保田 睦子(やすだ むつこ)
科学技術振興機構 戦略研究推進部 ライフイノベーション・グループ
〒102-0076 東京都千代田区五番町7 K’s五番町
TEL:03-3512-3524 FAX:03-3222-2064
E-mail:crest”AT”jst.go.jp
AMED事業に関する問い合わせ先
国立研究開発法人日本医療研究開発機構 (AMED)
次世代がん医療創生研究事業 (P-CREATE)
TEL:03-6870-2219
E-mail:jisedaigan”AT”amed.go.jp
革新的先端研究開発支援事業(AMED-CREST)について
日本医療研究開発機構 シーズ開発・研究基盤事業部 革新的先端研究開発課
TEL:03-6870-2224
E-mail:kenkyuk-ask”AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和4年4月12日
最終更新日 令和4年4月12日


