脳の深部を非侵襲的に観察できる人工生物発光システムAkaBLIの開発
 霊長類動物に適用可能な高次脳機能をリアルタイムに可視化
霊長類動物に適用可能な高次脳機能をリアルタイムに可視化
理化学研究所の宮脇敦史チームリーダーらの共同研究グループは、ホタルが産生する化合物(基質)とタンパク質(酵素)をベースに新規の人工生物発光システムAkaBLI*を開発し、生きた動物個体深部からのシグナル検出能を飛躍的に向上させました。
- *AkaBLI:
- 2013年に開発した人工基質AkaLumineと、AkaLumineに合わせて開発した人工酵素Akalucで構成
取り組み
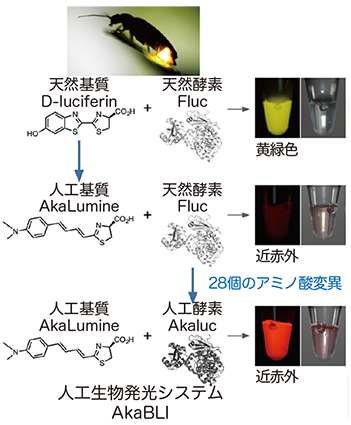
生物発光は、基質(ルシフェリン)が酵素(ルシフェラーゼ)によって酸化されることで起こります。生物発光のバイオイメージングでは2種類のルシフェリン(coelenterazineとD-luciferin)が用いられています。coelenterazineは哺乳類動物の体内では不安定で、ルシフェラーゼに到達する前に分解されるか、酸化して光ってしまいます。D-luciferinはホタルなどの陸生生物の発光に認められるルシフェリンで、哺乳類動物の体内で安定に存在し、これとホタルルシフェラーゼFlucとの組み合せ(ペア)が、in vivo バイオイメージングの世界標準として用いられています。
しかし、D-luciferinは、組織透過性が低く動物体内で不均一に分布してしまい、血液脳関門を通過しにくく腹腔内投与や経静脈投与で体内に送り込まれても、脳内で発現するルシフェラーゼまで到達しないという問題がありました。
この問題を解決するため、電気通信大学の牧昌次郎准教授らは2013年にD-luciferinの新規誘導体であるAkaLumineの合成に成功しました。AkaLumineは、動物体内で均一に分布し、組織透過性の高い赤色発光を示すという特長があります。
成果
本共同研究グループは、Flucに試験管内進化を施し、AkaLumineをさらに効率よく酸化する変異体を得ることを試みました(図1)。
大腸菌コロニーの発現系を構築し、AkaLumine噴霧によるコロニー発光の明るさを指標にスクリーニングを繰り返し、最終的に28個のアミノ酸置換をFlucに入れてAkalucを開発しました。
動物個体のバイオイメージングにおいて、対象部位が深いほどAkaBLIの威力は増大し、マウスを用いた実験では肺や脳の深部で、従来法と比較して100~1,000倍のシグナル量の増加が確認されました。ウイルスベクターを使ってマウスやマーモセットの線条体の一部の神経細胞にAkalucを発現させ、腹腔内にAkaLumineを投与したところ、頭表面で検出される発光シグナルを無麻酔・自由行動下で毎秒十数枚の速度でリアルタイムに観察することができました(図2)。
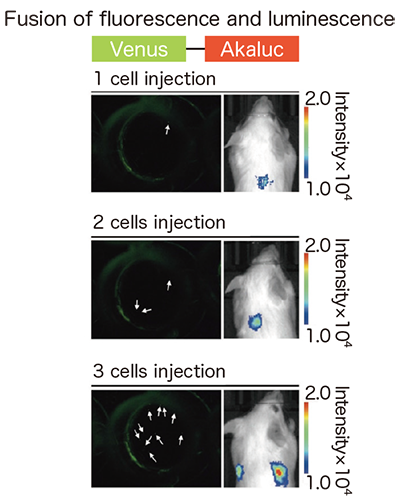
さらに、AkaBLIを使えば、同一マウス個体で、新奇環境探索に伴う海馬神経群の興奮を可視化し長期的に反復追跡できることを証明しました。また、マウスの尾静脈から腫瘍細胞を多数注入すると肺毛細血管にトラップされる現象に注目し、従来法が何万個もの腫瘍細胞注入を必要とするのに対して、AkaBLIでは1細胞のトラップで十分に可視化できることを証明しました(図3)。

展望
生物発光in vivo バイオイメージングの利点は、非侵襲性にあります。
さらにAkaBLIでは、発光シグナルが極めて明るい点から無麻酔かつ自由行動下でのシグナル追跡が可能となります。AkaBLIを基にカルシウムプローブなどの機能プローブが実用的に開発できれば、社会行動関連の脳活動を含めた高次脳機能をより自然な状況で調べることができます。脳以外の組織や器官においても、AkaBLIの適用が増えると考えられます。共同研究グループはAkalucの発現系を多様に進展させており、今後、少数の腫瘍細胞や幹細胞から生着、増殖、転移などの動態を高感度かつ定量的に観察することが期待されます。
関連リンク
最終更新日 令和2年6月23日


