若手あり 令和8年度 「難治性疾患実用化研究事業」に係る公募について
更新履歴
基本情報
| 公募の段階 | 公募 |
|---|---|
| 開発フェーズ | 基礎的,応用,非臨床研究・前臨床研究,臨床試験,治験,観察研究等 |
| 分野 | 医薬品プロジェクト,再生・細胞医療・遺伝子治療プロジェクト,データ利活用・ライフコースプロジェクト,難病・希少疾患 |
| 公募締め切り | 令和7年11月25日(火) 正午【厳守】 ※締め切りに間に合わず不受理となるケースが発生していますので、余裕を持った対応をお願いします。特にe-Radの新規利用者は、研究機関/研究者の新規登録手続も必要であり、これらに要する日数も考慮の上、早めの対応をお願いします。AMEDではe-Radに登録された研究提案情報をダウンロードして評価システムに組み入れています。提案書の記載情報とe-Radへの入力情報に齟齬がないよう、提案前に双方の記載内容を十分確認してください。 |
| お問い合わせ先 |
|
公募内容
令和8年度「難治性疾患実用化研究事業」に係る公募を行います。各公募研究開発課題の詳細は公募要領をご覧ください。
本公募には「若手育成枠」の対象となる研究開発課題が含まれています。
| 分野等 | 公募研究開発課題 | 研究開発費の規模 (間接経費を含まず) |
研究開発実施 予定期間 |
新規採択課題 予定数 |
|
|---|---|---|---|---|---|
| 医薬品分野 | |||||
| A-1 | 希少難治性疾患に対する画期的な医薬品の実用化に関する研究分野 | 医薬品のシーズ探索研究 (医薬品ステップ0) |
1課題あたり年間 20,000千円(上限) |
最長3年 令和8年4月(予定)~令和10年度末 |
0~5課題程度 |
| A-2 | 超希少難治性疾患に対する医薬品のシーズ探索研究 (医薬品ステップ0・超希少) |
1課題あたり年間 20,000千円(上限) |
0~3課題程度 | ||
| A-3 | 医薬品の治験準備 (医薬品ステップ1) |
1課題あたり年間60,000千円(上限) | 0~6課題程度 | ||
| A-4 | 医薬品の治験 (医薬品ステップ2) |
1課題あたり年間80,000千円(上限) ※ドラッグ・リポニショニングは60,000千円(上限) ※分散型臨床試験は、さらに20,000千円増額可能 |
0~1課題程度 | ||
| 再生・細胞医療・遺伝子治療分野 | |||||
| B-1 | 希少難治性疾患に対する画期的な再生・細胞医療・遺伝子治療の実用化に関する研究分野 | 再生・細胞医療・遺伝子治療のシーズ探索研究 (再生等ステップ0) |
1課題あたり年間 20,000千円(上限) |
最長3年 令和8年4月(予定)~令和10年度末 |
0~3課題程度 |
| B-2 | 再生・細胞医療・遺伝子治療の治験準備 (再生等ステップ1) |
1課題あたり年間 60,000千円(上限) |
0~1課題程度 | ||
| B-3 | 再生・細胞医療・遺伝子治療の治験 (再生等ステップ2) |
1課題あたり年間 80,000千円(上限) |
0~1課題程度 | ||
| 医療機器分野 | |||||
| C-1 | 希少難治性疾患に対する画期的な医療機器の実用化に関する研究分野 | 医療機器のシーズ探索 (医療機器ステップ0) |
1課題あたり年間20,000千円(上限) | 最長3年 令和8年4月(予定)~令和10年度末 |
0~1課題程度 |
| C-2 | 医療機器の治験準備 (医療機器ステップ1) |
1課題あたり年間60,000千円(上限) | 0~1課題程度 | ||
| C-3 | プログラム医療機器の研究開発 (SaMD) |
1課題あたり年間10,000千円(上限) | 0~1課題程度 | ||
| エビデンス創出分野 | |||||
| D-1 | 診療に直結するエビデンス創出研究分野 | 希少難治性疾患の診療に直結するエビデンス創出研究 | 1課題あたり年間 10,000千円(上限) (適応外の臨床研究を含む場合は15,000千円上限) |
最長3年 令和8年4月(予定)~令和10年度末 |
全体で 0~16課題程度 |
| D-2 | 小児期発症の希少難治性疾患の診療に直結するエビデンス創出研究(小児) | ||||
| D-3 | 超希少難治性疾患の診療に直結するエビデンス創出研究(超希少) | ||||
| D-4 | 希少難治性疾患のリアルワールドデータ利活用によるエビデンス創出研究(RWD) | ||||
| D-5 | 希少難治性疾患における栄養管理のエビデンス創出研究(栄養) | ||||
| 個別化医療分野 | |||||
| E-1 | 希少難治性疾患の個別化医療の推進等に資する研究分野 | 希少難治性疾患の個別化医療の実現に向けたゲノム研究(焦点領域深化型研究) | 1課題あたり年間 50,000千円(上限) |
最長3年 令和8年4月(予定)~令和10年度末 |
0~4課題程度 |
| E-2 | 希少難治性疾患の個別化医療の実現に向けたゲノム研究(先端技術探索型研究) | 1課題あたり年間 20,000千円(上限) |
0~3課題程度 | ||
| E-3 | 希少・未診断疾患におけるデータ駆動型創薬研究(IRUD利活用創薬) | 1課題あたり年間 35,000千円(上限) |
0~1課題程度 | ||
| E-4 | 希少・未診断疾患における病因遺伝子変異候補のモデル動物解析と創薬応用研究(モデル動物創薬) | 1課題あたり年間 35,000千円(上限) |
0~1課題程度 | ||
| E-5 | N-of-1+ 創薬推進に関する研究(N-of-1+創薬) | 1課題あたり初年度50,000千円(上限)-次年度以降年間70,000千円(上限) | 最長4年 令和8年4月(予定)~令和11年度末 |
0~1課題程度 | |
| 病態解明分野 | |||||
| F-1 | 希少難治性疾患の克服に結びつく病態解明研究分野 | 創薬標的の探索を目指した希少難治性疾患の病態解明 (病態解明・Research 0) |
1課題あたり年間 10,000千円(上限) |
最長3年 令和8年4月(予定)~令和10年度末 |
0~7課題程度 |
| F-2 | 若手研究開発代表者による創薬標的の探索を目指した希少難治性疾患の病態解明 (病態解明・若手・Research Y0) |
1課題あたり年間 7,500千円(上限) |
0~4課題程度 | ||
| F-3 | 希少難治性疾患の病態解明により見出した創薬標的の検証 (病態解明・Research 1) |
1課題あたり年間 15,000千円(上限) |
0~2課題程度 | ||
| F-4 | 若手研究開発代表者による希少難治性疾患の病態解明により見出した創薬標的の検証 (病態解明・若手・Research Y1) |
1課題あたり年間 15,000千円(上限) |
0~1課題程度 | ||
公募要領に記載されている各研究開発課題の詳細を確認した上で、応募する研究開発課題を選択してください。
【参考】令和8年度 難治性疾患実用化研究事業における応募指標
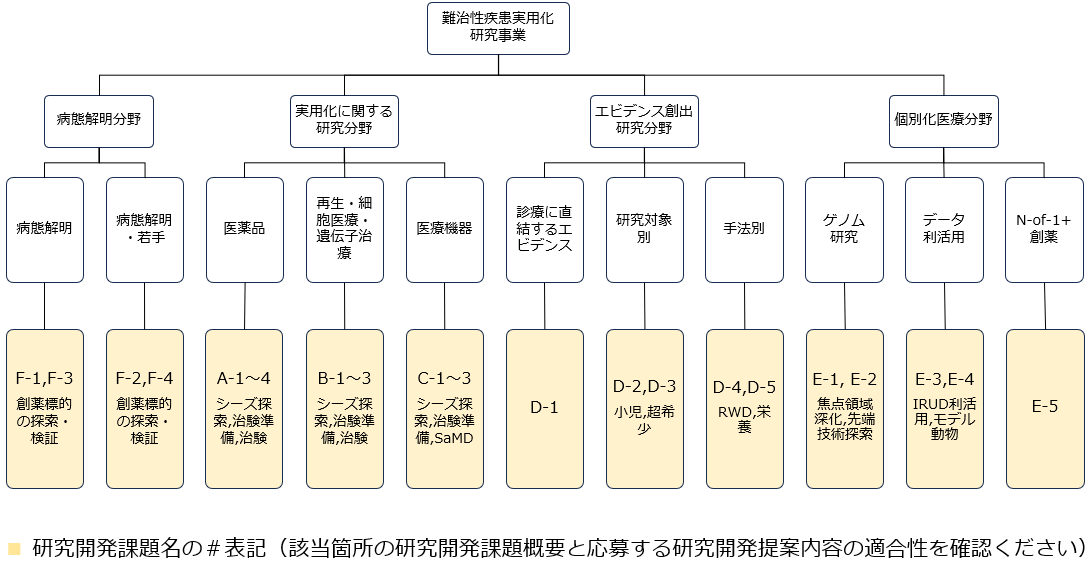
※エビデンス創出研究分野における提案課題とそれぞれの公募枠の適合性につきましては、公募要領(エビデンス)記載の提案対応図をご確認ください。
令和8年度難治性疾患実用化研究事業に研究開発代表者として参画を予定している場合(令和8年度の応募又は令和8年度の継続契約)、病態解明分野(F-1~4)には研究開発代表者として応募できません。ただし、研究開発分担者の立場であれば複数の課題に参加可能です。
事業概要
本事業は、「希少性」、「原因不明」、「効果的な治療方法未確立」、「生活面への長期にわたる支障」の4要件を満たす希少難治性疾患を対象として、病因・病態の解明、画期的な診断・治療・予防法の開発を推進することで、希少難治性疾患の克服を目指すものです。
事業の案内ページ
応募資格者
本事業の応募資格者は、一定の要件を満たす国内の研究機関等に所属し、かつ、主たる研究場所※とし、応募に係る研究開発課題について、研究開発実施計画の策定や成果の取りまとめなどの責任を担う能力を有する研究者(研究開発代表者)とします。
※ 所属する研究機関等と主たる研究場所が異なる場合は、別途ご相談ください。
なお、特定の研究機関等に所属していない、もしくは日本国外の研究機関等に所属している研究者にあっては、研究開発代表者として採択された場合、契約締結日までに、日本国内の研究機関に所属して研究を実施する体制を取ることが可能な研究者も応募できます。ただし、契約締結日までに、上記条件を備えていない場合、原則として、採択は取消しとなります。また、委託研究開発契約の履行能力を確認するため、審査時に、代表機関及び分担機関の営む主な事業内容、資産及び負債等財務に関する資料等の提出を求めることがあります。(詳細は公募要領「第3章 応募要項」を参照してください)
スタートアップ企業等の応募も可能です。ただし財務状況の健全性が応募時、採択時、研究進捗確認時に確認できることが必要です(審査時に財務状況が著しく脆弱と判断されると不採択となる場合があります)。
公募期間
ヒアリング日程
| 対象公募枠 | 実施日(予定) |
|---|---|
| A-1 医薬品ステップ0 A-2 医薬品ステップ0・超希少 B-1 再生等ステップ0 |
令和8年1月30日(金),2月2日(月) |
| A-3 医薬品ステップ1 A-4 医薬品ステップ2 B-2 再生等ステップ1 B-3 再生等ステップ2 |
令和8年2月3日(火),2月4日(水) |
| C-1 医療機器ステップ0 C-2 医療機器ステップ1 C-3 SaMD |
令和8年2月9日(月) |
| D-1~5 エビデンス創出研究 | 令和8年2月2日(月),2月6日(金),2月9日(月) |
| E-1,2 ゲノム研究 E-3 IRUD利活用創薬 E-4 モデル動物創薬 E-5 N-of-1+創薬 |
令和8年2月3日(月),2月10日(火) |
| F-1 病態解明・R0 F-2 病態解明・若手・RY0 F-3 病態解明・R1 F-4 病態解明・若手・RY1 |
令和8年1月30日(金),2月5日(木),2月6日(金) |
※注意事項など、詳細は公募要領「第5章 審査」を参照してください。
公募説明会
応募方法
提案書類の様式等、応募に必要な資料はAMEDウェブサイトの公募情報からダウンロードの上、公募要領に従って研究開発提案書等を作成の上、e-Radよりご提出ください。詳細は公募要領「第4章 提案書類」及び「II-第1章 提案書類の入手・提出に関する補足」を参照してください。
※応募する対象者は、原則として応募時までにe-Radに登録されていることが必要となります。研究機関の登録方法については、e-Radポータルサイトを参照してください。登録手続きに日数を要する場合がありますので、2週間以上の余裕をもって登録手続きをしてください。なお、一度登録が完了すれば、他制度・事業の応募の際に再度登録する必要はありません。また、他制度・事業で登録済みの場合は再度登録する必要はありません。
※e-Radからの申請に際して所属機関の承認が必要です。研究開発代表者から所属機関にe-Radで申請した段階では応募は完了していませんので、所属機関の承認の手続きを必ず行ってください。
※論文等の添付に際し、著作権等の問題が無いか確認願います。
応募先
参考情報
独立行政法人医薬品医療機器総合機構(PMDA)より、薬事承認を目指してシーズ開発等をされているアカデミアやベンチャー企業向けに、GLP試験の実施と承認申請における取扱いを説明した動画を作成し、ホームページで公開した旨の情報提供がありました(AMED-PMDA連携協定(平成27年8月19日付締結)に基づく情報提供)。
研究開発計画においてGLP試験を予定している先生方におかれましては、必要に応じてご参考にしていただき、研究開発計画作成の一助としていただけると幸いです。
資料
- 公募要領
- 応募先ガイド(医薬品,再生等,医療機器)
- 研究開発提案書【記載要領】(医薬品)
- 研究開発提案書【記載要領】(再生等)
- 研究開発提案書【記載要領】(医療機器)
- 研究開発提案書【記載要領】(病態解明)
- 研究開発提案書【記入用】(医薬品)
- 研究開発提案書【記入用】(再生等)
- 研究開発提案書【記入用】(医療機器)
- 研究開発提案書【記入用】(エビデンス創出)
- 研究開発提案書【記入用】(個別化医療)
- 研究開発提案書【記入用】(病態解明)
- 研究開発提案書別紙(非臨床試験サマリー)【記載例】
- 研究開発提案書別紙(非臨床試験サマリー)【記入用】
- 研究開発提案書別紙(非臨床試験ガントチャート)【記入用】
- 研究開発提案書別紙(薬事承認までのロードマップ)
- ヒト全ゲノムシークエンス解析プロトコール様式
- ヒト全ゲノムシークエンスプロトコール様式について
- e-Rad操作マニュアル
関連リンク
掲載日 令和7年10月8日
最終更新日 令和7年11月20日


