プレスリリース ゲノム編集のための新たな「はさみ」のかたち―CRISPR-Cpf1の構造解明―
プレスリリース
東京大学大学院理学系研究科・理学部
国立研究開発法人日本医療研究開発機構
発表者
西増 弘志(東京大学理学系研究科生物科学専攻 助教/JST さきがけ)
石谷 隆一郎(東京大学理学系研究科生物科学専攻 准教授)
Feng Zhang(Broad Institute of MIT and Harvard Core Member)
濡木 理(東京大学理学系研究科生物科学専攻 教授)
発表のポイント
- 新たなゲノム編集(注1)ツールとして注目されるCRISPR-Cpf1(注2)の分子構造を世界で初めて明らかにした。
- ゲノム編集ツールとして普及しているCRISPR-Cas9(注3)との機能の違いを原子レベルで明らかにした。
- CRISPR-Cpf1を利用したゲノム編集技術の高度化および効率化が期待される。
発表概要
発表内容
近年、生命の設計図であるゲノムDNAの塩基配列を書き換える「ゲノム編集」とよばれる技術が大きな注目を集めています。ゲノム編集技術は革新的な実験技術として医学・生命科学研究の現場において瞬く間に普及し、すでに多くの画期的な研究成果を生み出しています。さらに、動植物の品種改良や遺伝子治療といった応用も期待されています。現在、ゲノム編集にはCas9とよばれるタンパク質が利用されています。昨年、Cas9に加え、Cpf1とよばれる新規のタンパク質もゲノム編集に利用できることが報告されました。Cpf1はCas9と同様にガイドRNAと結合し、ガイドRNAの一部(ガイド配列)と相補的な2本鎖DNAを見つけ出し切断します(図1)。したがって、ガイド配列を変更することによりゲノムDNAのねらった場所を切断することができます。Cpf1とCas9はどちらもガイドRNAと協働して標的DNAを切断するはたらきをもちますが、DNAの「切り口」が異なります。すなわち、Cas9は二本鎖DNAを切断し平滑末端(注4)をつくるのに対し、Cpf1は突出末端(注5)をつくります(図1)。また、Cpf1はCas9よりも短いガイドRNAと結合してはたらきます。これまでに本研究グループはCas9の分子構造を決定し、そのDNA切断機構を明らかにしてきました。しかし、Cpf1がDNAを切断する分子機構は謎に包まれていました。
本研究グループはCpf1、ガイドRNA、標的DNAからなる複合体を結晶化し、大型放射光施設SPring-8およびSwiss Light SourceにおいてX線回折データを取得し、その立体構造を解明しました。その結果、Cpf1はCas9と大きく異なる立体構造をもつことが明らかになりました(図2)。特に、DNAの「はさみ」としてはたらく部分の構造はCpf1とCas9において大きく異なっていました。この構造の違いはCpf1とCas9によるDNAの「切り口」の違いとよく一致していました。これまでに立体構造を基にCas9の分子構造を改変した新規の研究ツールが開発されてきました。したがって、今回の研究成果は、Cpf1を改変した新規のゲノム編集ツールの開発につながることが期待されます。
本研究は、文部科学省(2014年度)・日本医療研究開発機構(AMED)(2015年度以降)革新的バイオ医薬品創出基盤技術開発事業「新規CRISPR-Cas9システムセットの開発とその医療応用」(研究代表者:濡木 理)、科学技術振興機構 戦略的創造研究推進事業(さきがけ)「立体構造にもとづく次世代ゲノム編集ツールの創出」(研究代表者:西増 弘志)の支援を受けて行われました。
発表雑誌
雑誌名:「Cell」(4月22日オンライン版公開予定)
論文タイトル:Crystal structure of Cpf1 in complex with guide RNA and target DNA
著者:Takashi Yamano,1,6 Hiroshi Nishimasu,1,2,6 Bernd Zetsche,3 Hisato Hirano,1 Ian M. Slaymaker,3 Yinqing Li,3 Iana Fedorova,4 Takanori Nakane,1 Kira S. Makarova,5 Eugene V. Koonin,5 Ryuichiro Ishitani,1 Feng Zhang,3,* and Osamu Nureki1,*
1.東京大学大学院理学系研究科
2.国立研究開発法人科学技術振興機構さきがけ
3.Broad Institute of MIT and Harvard
4.Skolkovo Institute of Science and Technology
5.NCBI, NLM, NIH
6.同等貢献
* 責任著者
DOI番号:http://dx.doi.org/10.1016/j.cell.2016.04.003
お問い合わせ先
研究に関すること
教授 濡木 理
Tel:03-5841-4392
E-mail:nureki“AT”bs.s.u-tokyo.ac.jp
報道に関すること
特任専門職員 武田加奈子、教授・広報室室長 山内 薫
Tel:03-5841-0654
E-mail:kouhou“AT”adm.s.u-tokyo.ac.jp
国立研究開発法人日本医療研究開発機構(AMED)
経営企画部 企画・広報グループ
Tel:03-6870-2245
AMEDの事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 医薬品研究課
革新的バイオ医薬品創出基盤技術開発事業担当
〒100-0004 東京都千代田区大手町1-7-1
Tel:03-6870-2219 Fax:03-6870-2244
※E-mailは上記アドレス“AT”の部分を@に変えてください。
用語解説
- 注1 ゲノム編集:
- 生命の設計図であるゲノムDNAの塩基配列を改変する技術。CRISPR-Cas9(clustered regularly interspaced short palindromic repeats/CRISPR associated proteins)の発見により迅速・簡便なゲノム編集が可能になった。
- 注2 CRISPR-Cpf1:
- 微生物のもつ獲得免疫機構のひとつ。2015年に発見された。Cpf1タンパク質はガイドRNAと結合し、ガイドRNAの一部(ガイド配列)と相補的な2本鎖DNAを切断する。したがって、ガイド配列を交換することにより任意の塩基配列をもつDNAを切断することができる。Cpf1タンパク質をCRISPR-Cpf1とよぶこともある。
- 注3 CRISPR-Cas9:
- 微生物のもつ獲得免疫機構のひとつ。Cas9はガイドRNAと結合し、ガイドRNAの一部(ガイド配列)と相補的な2本鎖DNAを切断する機能をもつ。したがって、ガイド配列を交換することにより任意の塩基配列をもつDNAを切断することができる。Cas9の機能は2012年に解明された。Cas9タンパク質をCRISPR-Cas9とよぶこともある。
- 注4 平滑末端:
- 2本鎖DNAを形成するDNA鎖のどちらも突出していない末端構造。
- 注5 突出末端:
- 2本鎖DNAを形成するDNA鎖の片方が突出している末端構造。
添付資料
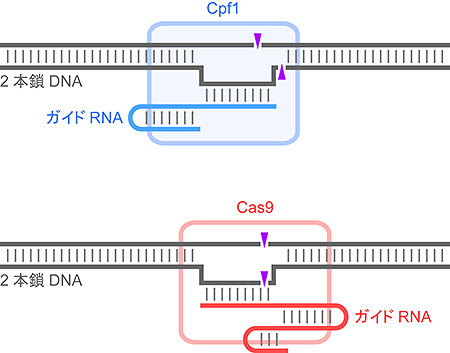
図1 Cpf1とCas9によるDNA切断機構
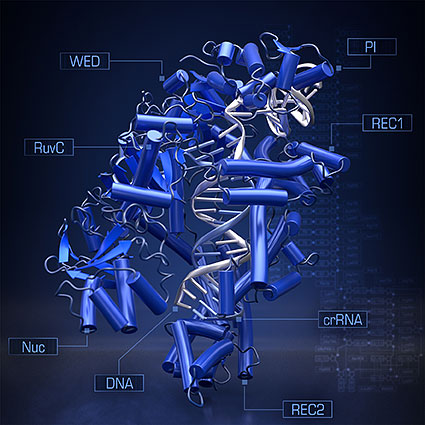
図2 Cpf1-ガイドRNA-標的DNA複合体の結晶構造
RuvC、Nucとよばれる部分がDNAを切断する「はさみ」としてはたらく。
掲載日 平成28年4月22日
最終更新日 平成28年4月22日


