プレスリリース iPS細胞を高品質かつ高効率に作製することに成功
プレスリリース
慶應義塾大学医学部
国立研究開発法人日本医療研究開発機構
このたび、慶應義塾大学医学部 内科学(循環器)教室の福田恵一教授、湯浅慎介専任講師、慶應義塾大学病院 予防医療センターの國富晃助教らは、筑波大学動物実験学研究室との共同研究により、卵細胞のみが持つ新しい因子を用いて、従来の方法よりも高品質なiPS細胞(注1)を効率良く作製することに成功しました。
iPS細胞は簡単に体細胞から作製することが可能であり、様々な細胞に分化する能力(多分化能)を備えています。一方で、現在の技術では、作製されたiPS細胞のさまざまな特性にバラつきがあるため、再生医療や疾患解析の応用の際、大きな課題となっていました。
本研究グループは、遺伝子の初期化は受精直後の段階で達成されることに着目し、卵細胞に含まれる成分が遺伝子の初期化に関わっていると仮定し研究を進めてきました。その結果、H1fooという卵細胞特異的なリンカーヒストン(注2)と、京都大学の山中教授が発見した4つの転写因子のうち3つを一緒に体細胞に発現させると、より高い多分化能を持つiPS細胞が高効率で作製できることを発見しました。今回の研究成果は、より高品質なiPS細胞を高効率に作製することで、再生医療の発展に大きく貢献することが期待されます。
本研究成果は、2016年5月26日(米国東部時間)に米国科学誌「Stem Cell Reports」にオンラインで公開されます。
研究の背景と概要
京都大学の山中伸弥教授らにより胚性幹細胞(ES細胞(注3))に多く発現する4つの転写因子であるOct4、Sox2、Klf4、c-Mycを体細胞に人工的に発現させると、体細胞が初期化され人工多能性幹細胞(iPS細胞)が容易に作製されることが示されました。しかし作製されたiPS細胞は、ES細胞と比較して様々なタイプの細胞に分化する能力(多分化能)が劣り、かつその能力もiPS細胞間でバラツキがあることが知られています。iPS細胞は再生医療や疾患解析などにおいて大きな可能性を示していますが、iPS細胞間におけるバラつきの存在はそれらの実現の障壁となっており、克服すべき大きな課題の一つとなっていました。
iPS細胞作製に汎用されているc-Mycは癌遺伝子であり、c-Mycの遺伝子導入は腫瘍発生が懸念されています。一方でc-Mycなしでの誘導ではiPS細胞作製効率が極めて低いという問題があり、これらを踏まえ安全かつより高い多分化能を均一に示す高品質なiPS細胞の高効率作製を実現する方法が望まれていました。
また、2012年に山中教授と共同でノーベル生理学・医学賞を受賞した英国のジョン・ガードン博士が世界で初めて報告した卵細胞への体細胞核移植(注4)による体細胞の初期化は、多能性幹細胞の作製に応用可能で、iPS細胞の作製法よりも高効率かつ早く初期化が進むことが知られています。よって卵細胞には、山中因子(注5)とは異なる初期化因子が存在することが示唆されています。近年これを裏付けるように、卵細胞内に存在する新規因子がiPS細胞の作製効率を改善させるとの報告が幾つか報告されています。
今回我々が着目したH1foo(エイチワンエフオーオー)は、卵細胞にのみに発現しているリンカーヒストンと呼ばれるタンパク質です。DNAは非常に長いひも状の構造を取っており、ヒストンとよばれるタンパクに巻き付いてヌクレオソームという構造を取り、効率よく細胞核内に収容されています。DNAが直接巻き付くヒストンをコアヒストンと呼びます。これに対しリンカーヒストンはヌクレオソーム間を結ぶリンカーDNA領域に結合し、ヌクレオソーム同士をコンパクトに折りたたむ作用を有し、特定の遺伝子の発現を抑制していると考えられています。しかし、卵細胞特異的リンカーヒストンであるH1fooは他の多くのリンカーヒストンと異なり、ヌクレオソーム同士を緩める作用があり、特定の遺伝子の発現を促進していると考えられます。(図1)H1fooは卵細胞への核移植の際に、体細胞の初期化に有利な環境を作る可能性が着目されており、我々はこの機能に注目しiPS細胞の作製に応用しました。
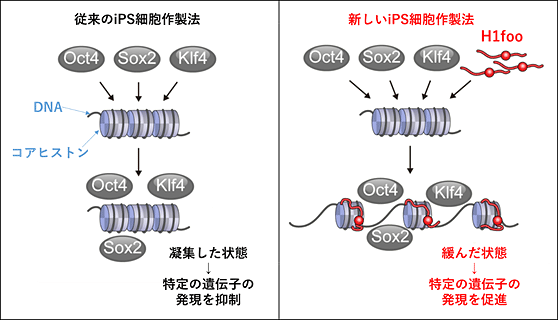 図1:iPS細胞作製過程における山中因子とH1fooのDNAに対する関係
図1:iPS細胞作製過程における山中因子とH1fooのDNAに対する関係
研究の成果と意義・今後の展開
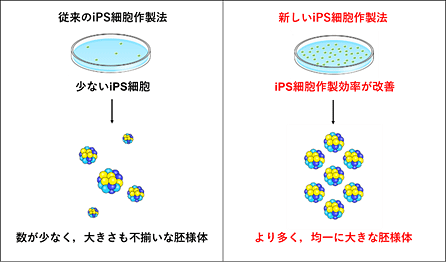 図2:iPS細胞から特定の細胞を分化誘導する為の胚様体作
図2:iPS細胞から特定の細胞を分化誘導する為の胚様体作
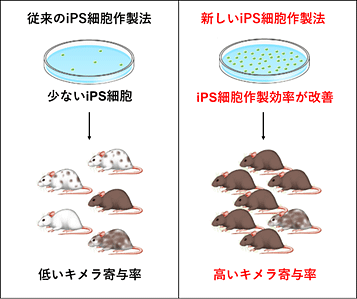 図3:iPS細胞から分化多能性評価の為のキメラマウス作成
図3:iPS細胞から分化多能性評価の為のキメラマウス作成
今後、iPS細胞は多くの目的とされる細胞へ分化誘導され、様々な用途で用いられることが予想されます。今後、H1fooを用いたヒトiPS細胞作製について、iPS細胞研究や臨床応用に大きく貢献することが期待されます。
特記事項
※このプログラムは平成27年度より日本医療研究開発機構に移管されました。
論文
- タイトル(和訳):
- H1foo has a pivotal role in qualifying induced pluripotent stem cells(H1fooはiPS細胞の質を規定する重要な役割を持つ)
- 著者:
- 國富晃、湯浅慎介、杉山文博、斎藤優樹、関倫久、楠本大、樫村晋、武井眞、遠山周吾、橋本寿之、江頭徹、谷本陽子、水野沙織、田中翔馬、奥野博庸、山澤一樹、渡辺秀生、小田真由美、金田るり、松崎有未、永井俊弘、岡野栄之、八神健一、田中守、福田恵一
- 掲載紙:
- 「Stem Cell Reports」
用語解説
- (注1)iPS細胞:
- 人工多能性幹細胞(induced pluripotent stem cell)と呼ばれ、体細胞に複数の遺伝子を導入して作製される。ES細胞のように多くの種類の細胞に分化できる多分化能と自己複製能を有する。2006年に京都大学の山中伸弥教授らが最初に報告した。
- (注2)リンカーヒストン:
- リンカーヒストンはヌクレオソーム間を結ぶリンカーDNA領域に結合するタンパク質。体細胞に多く発現しているリンカーヒストンはDNA構造を凝集させ遺伝子発現を抑制しているが、卵細胞特異的リンカーヒストンであるH1fooはDNA構造を緩んだ状態にすることにより特定の遺伝子の発現を促進していると考えられる。
- (注3)ES細胞:
- 胚性幹細胞(embryonic stem cell)と呼ばれ、胚盤胞と呼ばれる初期胚から細胞を取り出し、培養することで作製される。多分化能と自己複製能を有している。受精卵を破壊する必要があるため、ヒトES細胞の作製と利用には倫理的問題が生じる他、自己の細胞から作製することが困難である。
- (注4)核移植:
- 細胞の核を、他の細胞へ移植すること。体細胞の核を未受精卵に移植することで、体細胞を初期化しクローンを得ることに利用されている。最初のクローン動物は1962年に英国ケンブリッジ大学のジョン・ガードン博士によりアフリカツメガエルから作製された。
- (注5)山中因子:
- 山中伸弥教授らが報告した、iPS細胞を作成する際に導入するOct4、Sox2、Klf4、c-Mycの4つの遺伝子。
- (注6)Nanog:
- ES細胞などの多能性幹細胞や初期胚に特異的に発現している多能性遺伝子。質の高い多能性幹細胞では高発現している遺伝子として知られている。
- (注7)胚様体:
- ES細胞やiPS細胞を浮遊培養の条件で分化へと誘導すると、ボール状の細胞塊を形成し、様々な細胞種へ分化していく。特定の細胞への分化誘導や、細胞の多分化能を調べる一般的な方法。
- (注8)キメラマウス:
- マウスの初期胚の中に多能性幹細胞を移植することにより、誕生する2種類の細胞に由来するマウス。毛色が黒色のマウスから作られたiPS細胞を、白色マウスの初期胚に移植すると、誕生するマウスの毛色は黒もしくは黒と白とのまだらになる。iPS細胞の多分化能が優れているほどマウスの色はより黒に近くなり、これをキメラ寄与率が高いと表現する。
お問い合わせ先
本発表資料のお問い合わせ先
湯浅慎介(ゆあさ しんすけ)専任講師
〒160-8582 東京都新宿区信濃町35
TEL:03-5843-6702 FAX:03-5363-3875
E-mail:yuasa“AT”keio.jp
慶應義塾大学医学部 内科学教室(循環器)
福田恵一(ふくだ けいいち)教授
TEL:03-5363-3874 FAX:03-5356-3875
E-mail:kfukuda“AT”a2.keio.jp
広報に関するお問い合わせ
慶應義塾大学
信濃町キャンパス総務課:谷口・吉岡
〒160-8582 東京都新宿区信濃町35
TEL:03-5363-3611 FAX:03-5363-3612
E-mail:med-koho“AT”adst.keio.ac.jp
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構
戦略推進部 再生医療研究課
TEL:03-6870-2220
E-mail:saisei“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成28年5月27日
最終更新日 平成28年5月27日


