神経ストレスが胃がんの進行を加速させるメカニズムを解明、新たな治療標的に
プレスリリース
国立研究開発法人日本医療研究開発機構
発表者
発表のポイント
- 胃がんが進行する過程で、がん細胞が異常な神経細胞を呼び寄せ、集まった神経細胞からのストレス刺激が増えることで、ストレスを受けた胃がん細胞がさらに成長するという、胃がんの発育と神経ストレスの密接な関連とそのメカニズムを明らかにしました。
- 神経ストレスが胃がんに与える影響はこれまで詳しく分かっていませんでした。今回、神経細胞とがん細胞がどのような相互作用を持ちながらがんを形成していくかが詳細に明らかになりました。この相互作用を抑えることが、新しい胃がん治療として有効な可能性があります。
- がん細胞の増殖を直接抑える従来の抗がん剤に加えて、神経細胞との相互作用を抑える薬剤を使うことで、胃がん治療の効果を高めることができると考えられます。このような薬剤はすでにさまざまな疾患に使用されており、胃がんに対しても早期の臨床応用が期待されます。
発表概要
人間の神経細胞は脳だけでなく全身に分布しており、中でも胃腸には1億個以上のさまざまな神経細胞が存在し、胃腸の動きや消化ホルモンの分泌を調節しています。以前から神経ストレスががんやさまざまな病気の原因になる可能性は指摘されていましたが、その理由や重要性についてはよく分かっていませんでした。今回、東京大学医学部附属病院消化器内科の早河翼助教、小池和彦教授らは、米国コロンビア大学などと共同で、胃がんの発育と神経ストレスの密接な関連とそのメカニズムを明らかにしました。早河助教らはマウスの胃がん組織を詳しく観察し、胃がんが進行する過程で、がん細胞が「神経成長因子」と呼ばれるホルモンを産生し、これに反応した神経細胞ががん組織に集まり、そこからの強いストレス刺激を受けることで、胃がんの成長が加速していくことを世界で初めて明らかにしました。この「神経成長因子」を抑える薬や、神経ストレスを放出する細胞を除去することで、胃がんの進行を抑えることができました。がん細胞の増殖を直接抑える従来の抗がん剤に加えて神経細胞との相互作用を抑える薬剤を使うことで、胃がんに対する効果を高めて未来の治療に応用できると考えられます。実際、神経成長因子を標的にした薬剤はすでに臨床試験や実際の臨床でさまざまな疾患に使用されており、胃がんに対しても早期の臨床応用が期待されます。
本研究成果は、日本時間12月16日に米国のがん研究に関する学術誌「Cancer Cell」オンライン版にて発表されます。
なお、本研究は、国立研究開発法人日本医療研究開発機構(AMED)次世代がん医療創生研究事業(P-CREATE)、中山がん研究所消化器疾患研究助成金などの支援を得て行われました。
発表内容
研究の背景
胃がんに薬が効きにくいのは、腫瘍微小環境(注1)と呼ばれる胃がん細胞のまわりに存在するがん細胞以外の細胞が、がん細胞の増殖や生存を助けているのが一因と考えられています。最近がんに対する有効性が明らかになったPD-1阻害薬は、腫瘍微小環境を構成する免疫細胞に作用することで、抗がん作用を発揮します。腫瘍微小環境には免疫細胞のみならず、線維芽細胞や血管内皮細胞など多数の細胞が存在しておりますが、本研究グループは腫瘍内に存在する神経細胞に着目して研究を重ねてきました。以前の報告で、胃がんを発症するマウスに対して、迷走神経の外科的切除や、神経伝達物質阻害剤であるボツリヌス毒素の局所注射をすることで、発がんが著明に抑制されたことなどから、神経シグナルが胃がんに重要であることを明らかにしています(Zhao CM & Hayakawa Y et al, Sci Trans Med, 2014)。しかし、その詳細なメカニズムは分かっておらず、またこれらの手法は身体への負担や危険性が大きいことから、治療応用の実現には至っておりませんでした。
研究内容
がんの中の神経細胞の量が徐々に増えていくことに着目した研究グループは、増加したアセチルコリンががん細胞に働きかけて、神経を成長させる物質を放出させるのではないかという仮説をたてました。すると実際に、胃がん細胞では神経成長因子(NGF、注3)というホルモンがアセチルコリン刺激によって高発現することが分かりました。即ち、アセチルコリンとNGFを介した神経とがんの相互作用が存在し、がんの増殖を加速させている可能性が考えられました。そこで、研究グループはNGFを胃内に過剰発現するマウスを新たに作り出しました。すると、このマウスの胃内には異常な神経が発育し、結果として自然に胃がんを生じることが分かりました。アセチルコリンの受容体を欠損したマウスや、NGF受容体阻害剤を投与したマウス、アセチルコリンを産生するTuft cellを除去したマウスでは、こうした神経シグナルによる胃がん増殖効果が見られなくなることから、アセチルコリンを介した神経ストレスが胃がんの発生に直接関与することを明らかにしました。また、このストレスシグナルによって影響を受ける分子を詳細に観察したところ、YAP経路(注4)と呼ばれる転写調節因子がアセチルコリンによって直接活性化されることが分かりました。YAP経路の活性化及びNGFの高発現はヒトの胃がんの半数以上で認められることから、神経ストレスを介した胃がん増殖作用は多くの症例で重要な役割を果たしているものと考えられました。
社会的意義・今後の予定
発表雑誌
論文タイトル:Nerve growth factor promotes gastric tumorigenesis through aberrant cholinergic signaling.
著者:早河翼, 小西満, 新倉量太, 小池和彦(以上東京大学), 崎谷康佑, Samuel Asfaha, Daniel L. Worthley, Timothy C. Wang*(以上コロンビア大学), 他省略
DOI番号:10.1016/j.ccell.2016.11.005
アブストラクトURL:http://www.cell.com/cancer-cell/fulltext/S1535-6108(16)30547-5
お問い合わせ先
研究内容に関するお問い合わせ先
東京大学医学部附属病院 消化器内科
助教 早河 翼(はやかわ よく)
電話:03-3815-5411(代表)
E-mail:yhayakawa-tky“AT”umin.ac.jp
取材に関するお問い合わせ先
東京大学医学部附属病院 パブリック・リレーションセンター
担当:渡部、小岩井
電話:03-5800-9188 E-mail:pr“AT”adm.h.u-tokyo.ac.jp
AMEDの事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 がん研究課
〒100-0004 東京都千代田区大手町1-7-1
電話: 03-6870-2221 E-mail:cancer“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
用語解説
- (注1)腫瘍微小環境:
- がん組織の中で、がん細胞の周囲に存在する間質細胞の総称。免疫細胞、線維芽細胞、血管内皮細胞、神経細胞など、多様な細胞によって構成され、がん細胞の増殖を促進させる。
- (注2)刷子細胞(Tuft cell):
- 消化管粘膜上皮細胞の一種で、管腔内の刺激を受け取ったり、特定のホルモンを分泌したりする細胞集団。がんや前がん病変の中で数が増加することが広く知らているが、その働きの詳細は不明。
- (注3)神経成長因子(NGF):
- 脳神経を含めた神経細胞全般の成長・生存を強力に促すホルモンで、神経組織の構成に極めて重要な分子。いくつかのがんでも高発現していることが知られている。NGFは細胞表面のTrkという受容体と結合してその効果を発揮する。ある種のがんではTrk遺伝子の変異が見られ、この変異型Trk発現癌症例を対象としたTrk阻害薬の検討が臨床試験で行われている。抗NGF抗体は、疼痛を抑える作用があるとして他の治療が無効な疼痛患者に対する臨床試験が行われている。今回の研究成果から、Trk阻害薬や抗NGF抗体の適応をより幅広い胃がん症例に広げて効果を検証すべきものと考えている。
- (注4)YAP経路:
- 多くの転写因子・シグナル伝達経路と相互作用を持つ生体に非常に重要な転写調節因子。炎症・再生・癌など幅広い疾患と関わりがあるとされる。
添付資料:
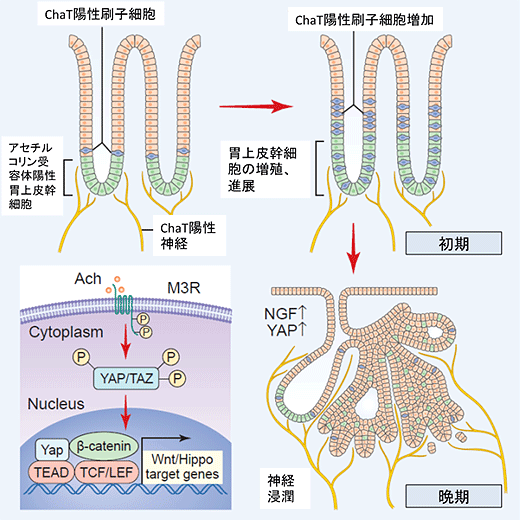
図:神経関連シグナルががんの成長を促進させる様子
胃の幹細胞のまわりには神経細胞と刷子細胞が密集しており、がんができる過程でまず刷子細胞が増加し、アセチルコリンを分泌して幹細胞を刺激する。進行すると、がん細胞から発生するNGFに神経が引き寄せられ、さらに多くのアセチルコリンががんの成長を加速させる。アセチルコリンはM3Rという受容体を介し、YAP経路を活性化させることで、がんの進展を起こしていると考えられている。
最終更新日 平成28年12月16日


