プレスリリース 脳梗塞患者を対象とした自家骨髄幹細胞移植治療(医師主導治験)開始のお知らせ-国内で初めての脳梗塞への直接投与法での再生医療等製品の治験開始-
プレスリリース
国立大学法人北海道大学
国立研究開発法人日本医療研究開発機構
ポイント
・脳梗塞急性期患者を対象とした直接投与による幹細胞移植の治験は日本で初めてです。
・1例目の患者さんへの移植手術が安全に終了しました
・今後、治験の結果を受けて、再生医療等製品1)としての承認を目指します。
概要
北海道大学病院は脳梗塞急性期に対する自家骨髄幹細胞直接移植の医師主導治験を平成29年4月から開始しました。本学大学院脳神経外科学分野(寳金清博教授、川堀真人特任助教)、本学臨床研究開発センター(七戸准教授)、富山大学脳神経外科学分野(黒田敏教授)を中心とした共同研究による成果です。
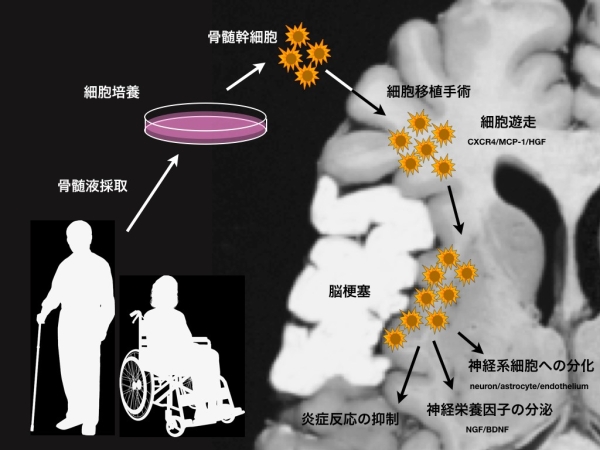
北海道大学脳神経外科教室では2001年より骨髄幹細胞を用いた脳梗塞を含む中枢神経疾患に対する基礎的研究を続け、脳梗塞患者へ骨髄幹細胞を用いた直接投与法による治療は効果が予想されると考えました。これら基礎的研究の結果を元に、2012年より厚生労働省「革新的再生医療製品実用化促進事業」の支援を受けてさらに研究を加速させ、その後2015年からは国立研究開発法人日本医療研究開発機構(AMED)の「再生医療実用化研究事業」の支援を受けています。
これらの成果をもとに平成29年1月18日に独立行政法人医薬品医療機器総合機構に治験届「脳梗塞急性期患者を対象とした自家骨髄幹細胞脳内投与による再生医療の医師主導治験」を提出しました。2017年8月に第1例目の患者さんへご自身の幹細胞を投与する移植手術を行い、安全に手術が終了したことを確認しています。
背景
脳卒中、特にその大部分を占める脳梗塞は、脳の血管が詰まることによって、手足を動かす運動機能や言葉などの言語機能を司る脳の一部に酸素と栄養が届かなくなり、それらの機能が傷害される病気です。日本全国で1年間に約30万人が新たに発症し、その多くが死亡もしくは後遺症を残す重篤な疾患です。2025年には520万人の後遺症による要介護者が推定され、それに伴う社会的負担も増大することが考えられることからも、より有効な治療法が求められています。
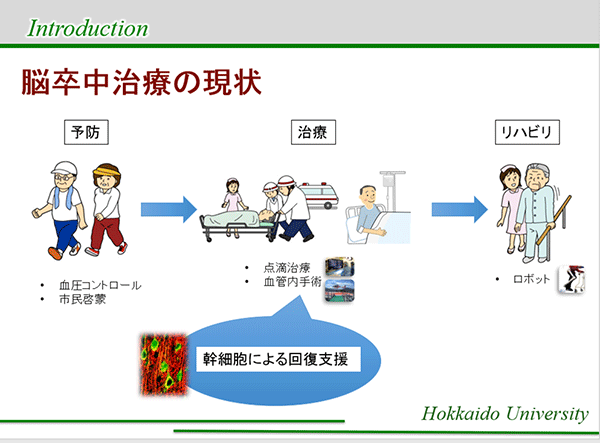
しかし脳卒中が他の疾病と比較し治療が困難となることの原因の一つとして、「一旦傷害された脳神経組織を再生させる治療法」が確立していないことが上げられます。そのため治療法の主眼は、「障害を可能な限り軽度でとどめる超急性期(発症から12時間以内程度)の治療法」と「慢性期以降のリハビリによる機能回復」になってきますが、脳梗塞においては血管閉塞を生じてから脳神経組織が傷害されるまでの時間は非常に短く、有効と考えられる超急性期のカテーテル治療に時間的に間に合う患者はそれほど多くありません。また近年はロボットを用いた新たなリハビリ方法も始まっていますがその効果も限定的であり、多くの患者に後遺症が生じているというのが現状です。このような状況の中で、近年の神経科学と幹細胞研究の進歩により、「一旦傷害された脳神経組織を再生させる治療法」、つまり再生医療が可能となりつつあります。
これまでに、北海道大学脳神経外科では骨髄間質細胞が脳内で生育し増殖すること、脳梗塞部に直接投与することで障害部位へ遊走し神経細胞に分化することや、栄養因子を出すことで運動機能を回復すること、などを報告してきました。 そこで、今回少数の患者さんで患者さん本人の骨髄間質細胞を培養増殖し、脳に直接投与する臨床研究を安全性に重点をおいて調べる治験を計画しました。
治験の概要
この治験では脳梗塞急性期(発症して間もない)患者様本人の腰の骨(腸骨)から骨髄幹細胞を取り出し、北大病院内に設置されている細胞培養室(Cell processing center)にて培養増殖(3-5週間程度かかります)を行い、規定の細胞数に達した後に専用の機器を用いて脳内に直接投与します。その後1年間にわたって安全性および有効性を確認することを目的としています。また、健常なボランティアから頂いた血小板を用いて細胞を増殖させる細胞培養法や脳ナビゲーションを用いた安全な移植法、移植細胞を体外から確認できるような標識法など世界的に非常に新しい方法を用いてより安全に治験を行うことも目的としています。
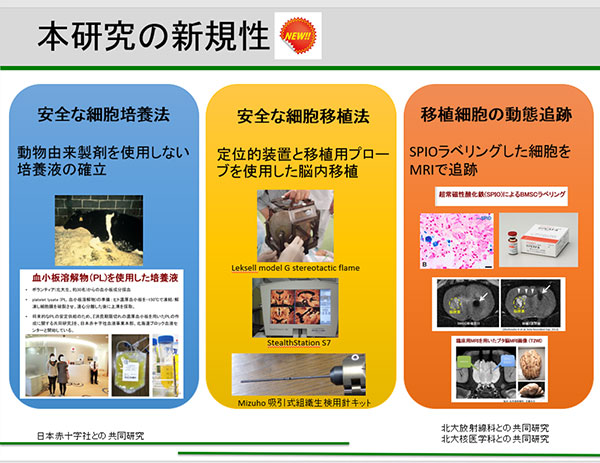
対象患者とスケジュール
- 同意取得時において年齢が20歳以上、80歳未満の患者
- 同意取得時において脳梗塞発症後14日以内の患者
- 内頚動脈灌流域に生じた脳梗塞の患者
- 自己報告又は家族の報告による脳梗塞発症前のmRSが0又は1である患者
- 本治験への参加にあたり十分な説明を受けた後、十分な理解の上、患者本人の自由意思による文書同意が得られた患者。本人が自署できない場合は、立会人による対応も可とする。また、患者本人の理解力や意思表示力が十全でない可能性がある場合は、代諾者の文書同意が得られた患者。
- 脳梗塞による中等?重度の神経症状(NIHSS:≧6)を有する患者(ただしNIHSSの「5.上肢の運動」と「6.下肢の運動」項目において総計6点以上であること)
治験参加の方法
本治験では細胞培養および治験製品移植は、入院を伴う手術となります。治験製品移植に関する入院費用・手術費用は研究費から支払われますが、通常の脳梗塞に関する入院費は患者さん本人の負担となります。その他にもMRI検査など患者さん本人の負担となる費用についての取り決めが行われています。実際の患者さん本人の病院への支払額は患者さんの加入する保険の種類によって異なります。
本治験への参加をご希望の一般の方は、末尾の【問い合わせ先】からお問い合わせ下さい。
特記事項
- 日本医療研究開発機構 再生医療実用化研究事業
(企業等の協力を得ながらプロトコールを組む治験)
用語解説
- 1)再生医療等製品
- 再生医療等製品とは、人又は動物の生きた細胞や組織を培養等の加工を施し作成されたもので、体の構造・機能の再建・修復・形成や疾病の治療・予防、遺伝子治療を目的として使用されます。金属などの材料でできた製品よりも人のからだに馴染みやすいなどの理由から、医薬品や医療機器のように用いることができます。しかし再生医療等製品を医療に用いることを目的として世に出すためには、医薬品や医療機器と同じように、非臨床試験(動物実験など)、臨床研究、治験、厚生労働省での審査、承認・販売といった順序で、いろいろなことを調べていく必要があります。
- 2) 医師主導治験
- 治験のうち、治験を行う医師が自ら計画を立て行うものを「医師主導治験」といいます。医師主導治験は医師自らが、治験の計画を作成し、治験の実施から試験結果の取りまとめまで、すべての業務を実施・統括して行う治験です。医師主導治験では、外国で有効性・安全性が確立した医薬品等で、国内ではまだ承認されていない、あるいは国内で適応外使用となっているものや、大学などで開発された医薬品等の候補物質の有効性・安全性を探索することなどを目的として行われます。患者さんが医療の現場で必要性が高い医薬品等をより早く使用できるようにするために行われています。
お問い合わせ先
TEL:011-706-5987 FAX:011-706-7158
E-mail:kawabori"AT"med.hokudai.ac.jp
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構戦略推進部 再生医療研究課
TEL:03-6870-2220
E-mail:saisei"AT"amed.go.jp
※E-mailは上記アドレス"AT"の部分を@に変えてください。
関連リンク
掲載日 平成29年11月10日
最終更新日 平成29年11月10日


