神経の難病HAM(HTLV-1関連脊髄症)の治療に希望の光―医師主導治験により、抗CCR4抗体がHTLV-1感染細胞を減少させ、HAMへの治療効果を発揮することを証明―
プレスリリース
聖マリアンナ医科大学
国立研究開発法人日本医療研究開発機構
研究成果のポイント
- 神経難病HTLV-1関連脊髄症(HAM)患者を対象としたヒト化抗CCR4*1モノクローナル抗体(モガムリズマブ*2)を用いた第1/2a相試験*3(医師主導治験*4)を完遂しました。
- 抗CCR4抗体が「HTLV-1感染細胞を標的としてHAM患者脊髄の炎症を改善させる」という全く新しい作用メカニズムを持つHAMの根本的治療薬となる可能性を示しました。
- 強力な治療が必要な白血病・リンパ腫の治療薬である抗CCR4抗体を、慢性疾患HAMの患者に対して安全に長期の使用を可能とする投与方法を開発しました。
- HAM患者に対する症状改善効果や成人T細胞白血病リンパ腫*5への進展予防効果も示唆され、抗CCR4抗体は画期的なHAM治療薬として期待できます。
要旨
聖マリアンナ医科大学 難病治療研究センター&先端医療開発学 山野嘉久教授、佐藤知雄准教授らの研究グループは、神経難病であるHTLV-1関連脊髄症(HAM)の患者を対象とした抗CCR4抗体(モガムリズマブ)の医師主導治験(第1/2a相試験)を実施し、抗CCR4抗体がHAMの病因となるHTLV-1感染細胞を劇的に減少させる効果を発揮し、脊髄での炎症レベルを改善させることを世界で初めて示しました。
この治験により、本製剤のHAM患者に対する安全性が確認されたうえ、本製剤が臨床症状を改善し、さらにはHTLV-1感染細胞ががん化して発症する成人T細胞白血病リンパ腫(ATL)への進展を予防する可能性があることもわかりました。
本研究は、日本医療研究開発機構「難治性疾患実用化研究事業」の支援を受けて実施されました。
研究成果は、国際医学雑誌The NEW ENGLAND JOURNAL of MEDICINE(ニューイングランド・ジャーナル・オブ・メディシン)に、2018年2月7日午後5時(米国東部時間)発表されます。
背景
HTLV-1関連脊髄症(HTLV-1-Associated Myelopathy:HAM)は、患者数が全国で推定3000名の希少疾患で、指定難病の1つです。脊髄が次第に傷害されることで、歩行困難、排尿・排便障害、足のしびれや痛みなどの症状が進行し、最終的には車いすや寝たきりの生活を余儀なくされる難病で、深刻な生活の質の低下を引き起こします。
HAMの原因となるヒトT細胞白血病ウイルスI型(HTLV-1)は、主にCD4陽性T細胞に持続感染するウイルスで、その感染者は世界で約2~3千万人、日本に約100万人存在します。HTLV-1は、感染者のごく一部に重篤な病気、すなわち約0.3%にHAM、約5.0%に致死率の高い成人T細胞白血病リンパ腫(Adult T-cell Leukemia/Lymphoma:ATL)を引き起こし、HAMの患者さんがATLを発症するリスクもあります。現時点では残念ながらこれら疾患の有効な発症予防薬や治療薬は確立されていません。
実はこのHTLV-1は、世界のなかでも特に日本に感染者が多く、日本以外で感染者が多い地域は、カリブ海沿岸、南米、アフリカなどの発展途上国で、先進諸国では日本のみです。このような背景から、欧米先進国では新薬が開発される可能性は低く、世界中のHTLV-1感染者そしてHAMやATLの患者さんが、日本の研究に期待を寄せています。
これまでの研究成果から、HAMは、HTLV-1に感染した細胞が脊髄の中に入り込み、脊髄内で慢性的な炎症を引き起こした結果、神経組織が傷害・変性することによって起こると考えられています。現在HAMに対する治療として用いられているステロイドやインターフェロンαは、炎症を抑制する作用が中心で、症状の進行を遅らせる効果がありますが、症状の進行を抑えたり、予後を改善したりする効果まではほとんど得られないため、より有効で根治的な新薬の開発が望まれています。HAMでは血液中のHTLV-1感染細胞が多い人ほど長期予後が悪いという報告があることから、HTLV-1ウイルス量(HTLV-1感染細胞数)を減らす薬が根本的な治療薬になると期待されています。
そこで我々は、ウイルスの特徴を踏まえてHTLV-1感染細胞そのものを特異的に攻撃して破壊すれば、HTLV-1ウイルス量を減らすことができるのではないかと考えました。HAM患者のHTLV-1感染細胞の表面にある目印となる分子を探索したところ、ケモカイン受容体の一つであるCCR4が有望であること、さらにCCR4陽性のHTLV-1感染T細胞が炎症を促すような異常細胞に変化して、HAMの病因的役割を果たしていることがわかりました(PLoS One 2009, Brain 2013, J Clin Invest 2014)。これらの結果から、CCR4陽性T細胞はHAMの治療標的になり得ると考え、ヒト化抗CCR4抗体製剤の開発に成功していた国内企業と2007年から共同研究を開始し、HAM患者由来の細胞を用いた非臨床試験において、本製剤が抗HTLV-1感染細胞殺傷活性、抗炎症活性を有することを証明しました(J Infect Dis 2015)。
以上の結果を踏まえ、2013年11月より、既存治療で効果不十分なステロイド維持療法中のHAM患者を対象とした抗CCR4抗体の第1/2a相試験(UMIN 000012655)を、医師主導治験として開始しました。(詳細は、「臨床試験の内容と結果の要約」をご覧ください)
研究成果の要点
1)強力な治療が必要な白血病・リンパ腫の治療薬である抗CCR4抗体を、慢性疾患HAMの患者に対して安全に長期の使用を可能とする投与方法を開発した
抗CCR4抗体(モガムリズマブ)は、本治験の開始前である2012年、我が国でATLに対して承認されました。けれども、HAMとATLは病気の性質や治療目標が大きく異なるため、長期慢性の経過を示すHAMに抗CCR4抗体を上手く適用するためには、出来るだけ安全に使用できて、かつ有効性を確保できる用量や投与間隔を見いだす必要がありました(ATLの用量および投与間隔は、1.0mg/kg/bodyを週1回、8回投与)。
そこで我々は、HAM患者対象の非臨床データ(J Infect Dis 2015)や健康成人に対する単回投与データ等の結果から、HAM患者に対して有効性が期待できる最低投与量を0.003mg/kgと決定し、また安全性を確保できる最高投与量を、ATL対象の試験においてCTCAE*6の Grade 4以上の有害事象が認められていなかった0.3mg/kgと決定し、この間で5つの投与量レベルを設定することとしました(0.003mg/kg, 0.01mg/kg, 0.03mg/kg, 0.1mg/kg, 0.3mg/kg)。さらに、投与間隔は、単回投与の血中濃度のデータ等から、投与レベル0.003mg~0.03mg/kgでは8週間以上の投与間隔、投与レベル0.1mg~0.3mg/kgでは12週間以上の投与間隔を設けることとし、これらの条件で、低い投与量から安全性を確認しながら徐々に投与量を増加させる用量漸増試験を行う計画を立案しました。
その結果、第1相試験において、HAM患者では抗CCR4抗体は0.3mg/kgまで忍容性があることがわかりました。また、第2a相試験も含めた計10ヶ月間で、3か月以上の投与間隔を設けて投与することにより、慢性疾患HAMに対して安全に繰り返し投与可能であることが示されました。頻度の多い有害事象は皮疹、リンパ球減少、白血球減少でしたが、いずれも軽度であり、ATLの臨床試験で見られたような重篤な有害事象は認められませんでした。ただし、慢性疾患であるHAMでは、より長期投与の安全性に関する情報が重要であり、引き続き長期投与試験(UMIN000019942)を実施し、HAMに対する抗CCR4抗体の安全性の確認を継続しています。
2)抗CCR4抗体が「HTLV-1感染細胞を標的としてHAM患者脊髄の炎症を改善させる」という全く新しい作用メカニズムを持つ世界初のHAMの根本的治療薬となる可能性を示した
本試験では、抗CCR4抗体の投与によって、末梢血液中のHTLV-1プロウイルス量(HTLV-1感染細胞数)が減少するのみでなく、髄液中のHTLV-1プロウイルス絶対量の減少も認められました。抗CCR4抗体投与後の髄液における薬剤濃度を測定したところ、薬剤は検出されなかったことから、髄液中のHTLV-1感染細胞が減少したのは、末梢血液中の感染細胞が減少したことによる2次的なものと考えられます。すなわち、HAM患者において脊髄病変部に存在するHTLV-1感染細胞は、末梢から日々供給されていることが示唆されました。
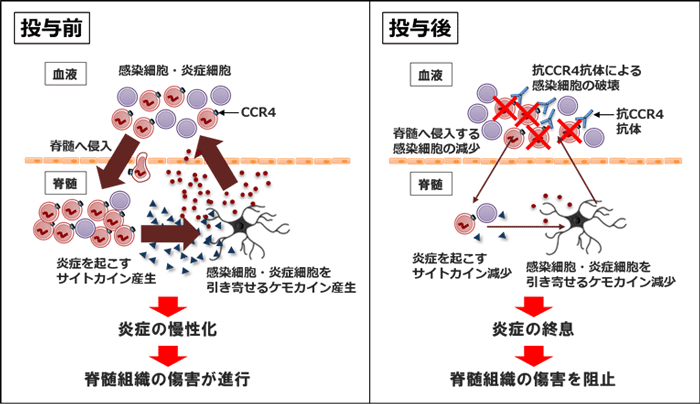
この結果は、我々がこれまでに示してきた以下の研究結果とも一致しています。その一つは、HAM患者の髄液細胞は増殖マーカーで染色しても陰性で、HTLV-1感染細胞は脊髄病変部では自発的に増えていないという結果です(J Clin Invest 2014)。もう一つは、最近我々が提唱したHAM患者の脊髄において炎症が慢性化するメカニズム(Brain 2013, Nat Rev Dis Primers 2015, J Neuroimmunol 2017)に関するもので、そのメカニズム(下図「投与前」参照)とは、HAM患者のHTLV-1感染細胞は脊髄で炎症を起こすサイトカイン(インターフェロンγ)を産生し、それが脊髄のグリア細胞の1つであるアストロサイトを刺激して、感染細胞や炎症細胞を引き寄せるケモカイン(CXCL10)の産生を誘導し、さらに感染細胞と炎症細胞が脊髄へ流入するという炎症ループがあるとするモデルです。このモデルが正しければ、末梢血中で感染細胞が減少すると、脊髄病巣への感染細胞の供給量が減り、脊髄の慢性炎症が治まることで、神経の傷害を阻止できるはずです。しかし、これまでHAM患者血液中のHTLV-1感染細胞を大きく減少させる薬剤は存在しませんでしたので、この仮説を証明することが出来ませんでした。今回の試験では、抗CCR4抗体がその投与濃度に応じて、HAM患者末梢血液中のHTLV-1感染細胞を減少させ、その減少の程度に応じて、脊髄の炎症レベルを改善させました(下図「投与後」参照)。したがって本試験の結果は、上記の病態モデルを裏付けるもので、HTLV-1感染細胞はHAMを発症させる単なる引き金ではなく、HAM患者脊髄における慢性炎症の維持に寄与していることを、世界で初めて直接的に証明することに成功しました。
3)既存治療で効果不十分なHAM患者に対する症状改善効果やATL進展予防効果も示唆され、抗CCR4抗体は画期的なHAM治療薬と期待できる
HAMは長期的にみて、症状が自然に寛解することはなく、徐々に進行していく病気です。本試験では、既存の治療では効果不十分でこれ以上の改善を期待できず、悪化していくのを待つのみという深刻な状況にある患者を対象としたにもかかわらず、試験終了までに、「下肢の筋緊張を評価する尺度」の改善を認めた例が78.9%、HAMの運動障害を13段階で評価する「納の運動障害重症度」まで改善を認めた例が31.6%ありました。このように抗CCR4抗体は、感染細胞殺傷効果、脊髄炎症改善効果のみならず、臨床症状改善効果まで有することが示唆されました。
さらに抗CCR4抗体がATLリスクの高い感染細胞集団を減少させ、繰り返し投与によりその状態を維持できることも示されたことから、抗CCR4抗体はATL進展予防効果もあることが示唆されました。最近の調査によって、HAM患者ではATLを発症する例が決して稀ではなく、抗CCR4抗体はHAM患者の機能予後のみならず、生命予後まで改善させる可能性があります。
今後の期待
HTLV-1感染細胞を標的とする抗CCR4抗体は、HAM患者の長期的な機能予後を改善させ、そのATL進展予防効果から、HAM患者の生命予後まで改善させる可能性があり、これまで実現できなかったHAMに対する根治的な画期的な薬剤となることが期待されます。
現在、多施設共同の検証的試験(第3相)が企業主導で開始され、数年以内にこの薬剤をHAM患者さんの元へ届けられるように進めています。将来的には、本薬剤を医療用ロボットスーツHALのようなリハビリテーションと効果的に組み合わせることで、革新的な次世代のHAM治療法が確立される可能性も期待されます。
また今回の研究により、「HAM患者の脊髄における慢性炎症がHTLV-1感染細胞に起因する」という仮説が、ヒトを対象として直接証明されたことで、HTLV-1感染細胞をHAMの治療標的とすることの重要性が明確に示されました。これはHAMの治療薬開発に関する1つの方向性を示した点で、今後のHAMの新薬開発に貢献できるものと考えられます。
本研究でHAM患者において示された、抗CCR4抗体のATL進展予防効果は、HAMだけに限定されるものではありません。ATLは、予後不良のaggressive ATLと比較的予後の良いindolent ATLに大きく分類されますが、aggressive ATLは一旦発症するとその治療は困難を極めます。またindolent ATLは約5年でaggressive ATLを発症しますが、本研究において証明された、HAMに対する抗CCR4抗体の安全性に優れた投与方法(用量や投与間隔)は、indolent ATL患者での進展予防治療にも応用できる可能性があります。このように本研究は、HAMの治療のみならず、致死率の高いATLの早期発見・早期治療、さらには発症予防を実現させるための、ブレイク・スルーとなる可能性があります。将来、本治療法が確立されれば、HAM、ATL患者のみならず、発病への不安を抱くHTLV-1感染者全体に福音をもたらすものとなるでしょう。
論文情報
- タイトル
- Mogamulizumab (Anti-CCR4) in HTLV-1-Associated Myelopathy
「HTLV-1関連脊髄症におけるモガムリズマブ(抗CCR4抗体)」 - 著者名
- Tomoo Sato, Ariella L. G. Coler-Reilly, Naoko Yagishita, Natsumi Araya, Eisuke Inoue, Rie Furuta, Toshiki Watanabe, Kaoru Uchimaru, Masao Matsuoka, Naoki Matsumoto, Yasuhiro Hasegawa, Yoshihisa Yamano
- 掲載誌
- The NEW ENGLAND JOURNAL of MEDICINE
用語解説
- 1 CCR4:
- CC chemokine receptor 4 (CCケモカイン受容体4)
- 2 モガムリズマブ:
- 細胞表面にあるCCR4を認識して、抗体依存性細胞傷害活性により、結合した細胞を破壊する作用のあるヒト化モノクローナル抗体
- 3 第1/2a相試験:
- 安全性を調べる第1相試験と安全性に加えて有効性・用法・用量を探索的に調べる早期第2相試験を組み合わせた臨床試験
- 4 医師主導治験:
- 国から「医薬品」として承認を受けるために行う臨床試験を治験といい、特に製薬企業ではなく、医師自らが主導して実施する治験を医師主導治験という
- 5 成人T細胞白血病リンパ腫(Adult T-cell Leukemia/Lymphoma, 略してATL):
- HAMと同じHTLV-1によって引き起こされる、致死率の高い生命予後不良の白血病・リンパ腫
- 6 CTCAE:
- Common Terminology Criteria for Adverse Eventsの略で、米国立がん研究所が主導し、世界共通で使用されることを意図して作成された有害事象に関しての評価規準。 CTCAEではGrade1(軽症)からGrade5(死亡)までの5段階で重症度を評価する。Grade4以上が生命を脅かすレベル。
臨床試験の内容と結果の要約
試験目的
HAM患者を対象として、抗CCR4抗体製剤(KW-0761;一般名モガムリズマブ)の用量制限毒性(DLT)の発現状況に基づき、最大耐用量(MTD)を明らかにする。同時に薬物動態について検討する。また副次的に抗感染細胞効果も検討する。さらに第2a相において、抗感染細胞効果の持続期間、10メートル歩行時間の非増悪期間を検討する。
試験デザイン
非盲検、第1/2a相臨床試験
実施医療機関
聖マリアンナ医科大学病院
被験者
既存治療で効果不十分なステロイド維持療法中のHAM患者(第1相試験:21名、第2a相試験:19名)
投与スケジュール
- 第1相:
- レベル1(0.003mg/kg)、レベル2(0.01mg/kg)、レベル3(0.03mg/kg)、レベル4(0.1mg/kg)、レベル5(0.3mg/kg)のレベル毎にそれぞれ3例ずつ、単回投与(点滴静注)を行い、12週間観察する。ただし、レベル1から段階的にレベルを上げていき、DLTが発生したレベルおよび最大投与可能量と決定したレベルにはさらに3例追加して単回投与を行う。
- 第2a相:
- 第1相の治験を完遂した症例のみ、第1相と同投与量レベルで再投与を開始し、24週間観察する。ウイルス量の減少効果が弱い場合は、2回目以降の再投与レベルを第1相で決定した最大耐容量までの範囲で1段階上げることを可能とする。ただし、レベル1~3は8週、レベル4・5は12週の投与間隔を空ける。
主要評価項目
- 安全性:
- 用量制限毒性(DLT)の発現状況に基づき最大耐用量(MTD)を明らかにする、有害事象の有無及びその内容、抗KW-0761中和抗体の発現人数
- 薬物動態:
- KW-0761単回投与時の血漿中濃度ならびに髄液中濃度
副次評価項目
- 有効性:
- [第1相]抗感染細胞効果(末梢血中のHTLV-1プロウイルス量)
- [第2a相]抗感染細胞効果の持続期間、10メートル歩行時間の非増悪期間
付随研究項目
髄液中のプロウイルス絶対量、血清・髄液の炎症マーカー、各種免疫系への影響、ATL前駆細胞率、感染細胞クローナリティ
結果の要約
- 安全性の結果
本治験では、CTCAE (有害事象共通用語規準) のGrade 4以上の重篤な有害事象は認められなかった。DLT に該当した有害事象は、投与量0.03 mg/kgで「アスパラギン酸アミノトランスフェラーゼ(AST)増加」(Grade3)が4.8%(1例/21例)に発現したが、一過性の事象であった。いずれの投与量レベルもMTD の定義には該当せず、本治験薬を単回投与した被験者に対し0.3 mg/kg までの忍容性が確認された。発現頻度の高かった有害事象は、皮疹(47.6%)、白血球減少とリンパ球減少(33.3%)であり、その程度はいずれもCTCAEのGrade 1または2と軽度であった。 - 有効性の結果
末梢血中のHTLV-1感染細胞数(HTLV-1プロウイルス量)の減少および髄液炎症マーカーとして測定したCXCL10とネオプテリン濃度の低下を認め、その効果はいずれもKW-0761濃度依存的であった。また髄液中のHTLV-1プロウイルス絶対量の減少効果も認められた。また、第2a相における繰り返し投与により、これらの低下効果は第2a相終了まで持続した。臨床的評価項目として、第2a相開始から24週目時点で下肢の痙性(改変アシュワーススケール)が約8割、納の運動障害重症度スケールが約3割の患者で改善を認めた。10メートル歩行時間も全評価期間を通して非増悪期間の持続が認められた。ATL前駆細胞率(CADM1+CD7-細胞率)および感染細胞メジャークローンは投与翌日には低下を認め、その効果は繰り返し投与により第2a相終了まで持続した。
お問い合わせ先
研究内容について
学校法人聖マリアンナ医科大学 難病治療研究センター 病因・病態解析部門
山野 嘉久
〒216-8512 神奈川県川崎市宮前区菅生2-16-1
TEL:044-977-8111
FAX:044-977-9772
E-mail:yyamano"AT"marianna-u.ac.jp
AMED事業について
国立研究開発法人日本医療研究開発機構
戦略推進部 難病研究課
東京都千代田区大手町1-7-1
TEL:03-6870-2223
E-mail:nambyo-info"AT"amed.go.jp
※E-mailは上記アドレス"AT"の部分を@に変えてください。
関連リンク
掲載日 平成30年2月8日
最終更新日 平成30年2月8日


