プレスリリース 乳がんの「ゲノム医療」に貢献―日本人遺伝性乳がんの病的バリアントデータベースを構築―
プレスリリース
理化学研究所
東京大学大学院新領域創成科学研究科
東京医科歯科大学
栃木県立がんセンター ゲノムセンター
昭和大学
国立がん研究センター
徳島大学
医療法人社団メタセコイア FMC東京クリニック
日本医療研究開発機構
理化学研究所(理研)生命医科学研究センター基盤技術開発研究チームの桃沢幸秀チームリーダー、統合生命医科学研究センターの久保充明副センター長(研究当時)らの国際共同研究グループ※は、乳がんの原因とされる11遺伝子について、世界最大規模となる合計18,000人以上のDNAを解析し、日本人遺伝性乳がんの「病的バリアント[1]」データベースを構築しました。
本研究成果は、日本の乳がん患者一人一人にあった治療を行う「ゲノム医療」に貢献すると期待できます。
乳がんは、日本人女性で最も患者数の多いがんであり、そのうち5~10%の患者はひとつの病的バリアント(個人間での1カ所のゲノム配列の違い)が原因になると推定されています。乳がんでは、BRCA1、BRCA2など11個の原因遺伝子が知られています。遺伝子検査により、乳がん患者が病的バリアントを持つことが分かれば、より適切な治療が可能になります。しかし、病的バリアントは人種によって大きく異なるため、日本人独自のデータベース構築が必要でした。今回、国際共同研究グループは11の原因遺伝子について、バイオバンク・ジャパン[2]により収集された日本人の乳がん患者群7,051人および対照群11,241人のDNAを、独自に開発したゲノム解析手法を用いて解析しました。その結果、244個の病的バリアントを同定するとともに、日本人に多い病的バリアント、遺伝子ごとの乳がんのリスク、病的バリアントを持つ人の臨床的特徴などを明らかにしました。これらの解析結果については、病的バリアントデータベースを構築しており、今後、そのサマリー情報は国内外の公的データベースにも登録、活用される予定です。
本研究は、英国のオンライン科学雑誌『Nature Communications』(10月4日付け:日本時間10月4日)に掲載されました。
※国際共同研究グループ
理化学研究所
生命医科学研究センター
基盤技術開発研究チーム
チームリーダー 桃沢 幸秀 (ももざわ ゆきひで)
技師 岩崎 雄介 (いわさき ゆうすけ)
統計解析研究チーム
チームリーダー 鎌谷 洋一郎(かまたに よういちろう)
客員主管研究員 高橋 篤 (たかはし あつし)
(国立循環器病研究センター研究所 病態ゲノム医学部 部長)
統合生命医科学研究センター(研究当時)
副センター長(研究当時) 久保 充明 (くぼ みちあき)
Division of Genetics and Population Health, QIMR Berghofer Medical Research Institute
(オーストラリア・ブリスベン)
グループリーダー アマンダ・B・スパードル(Amanda B. Spurdle)
研究アシスタント マイケル・T・パーソンズ(Michael T. Parsons)
医療法人社団メタセコイア FMC東京クリニック
認定遺伝カウンセラー 田村 智英子(たむら ちえこ)
徳島大学 先端酵素学研究所 プロテオゲノム研究領域 ゲノム制御学分野
領域長・教授 片桐 豊雅 (かたぎり とよまさ)
国立がん研究センター 中央病院 遺伝子診療部門
部門長 吉田 輝彦 (よしだ てるひこ)
昭和大学病院 乳腺外科
診療科長・教授 中村 清吾 (なかむら せいご)
栃木県立がんセンター ゲノムセンター がん予防・遺伝カウンセリング科
ゲノムセンター長 菅野 康吉 (すがの こうきち)
(国立がん研究センター中央病院 遺伝子診療部門・非常勤医員)
東京医科歯科大学 難治疾患研究所 分子遺伝分野
教授 三木 義男 (みき よしお)
東京大学 医科学研究所 ヒトゲノム解析センター シークエンス技術開発分野
特任助教 平田 真 (ひらた まこと)
(国立がん研究センター中央病院 遺伝子診療部門)
東京大学大学院 新領域創成科学研究科 クリニカルシークエンス分野
教授 松田 浩一 (まつだ こういち)
※研究支援
本研究は、日本医療研究開発機構(AMED)の「オーダーメイド医療の実現プログラム」の支援のもと行われました。
背景
乳がんは、日本人女性で最も患者数の多いがんであり、12人に1人の割合で罹患することが知られています注1)。乳がんの発症には、飲酒や肥満、身体活動度などの生活習慣要因だけではなく、遺伝的要因も大きく寄与しています。乳がん患者の5~10%は、個人間における1カ所のゲノム配列の違いによる「病的バリアント」が原因で発症していると推定されており、その病的バリアントが存在する原因遺伝子としてBRCA1、BRCA2など11遺伝子が知られています。そのため、乳がん患者の血液から得られるDNAを解析し、これらの11遺伝子に病的バリアントが存在することが明らかになれば、より適切な治療や検査を行うことが可能となります。
また、患者の近親者や家族内に多くの乳がん患者がいる人についても同様の遺伝子検査を実施し、病的バリアントを持っていることが明らかになれば、乳がんの早期発見や治療が期待できます。2013年、この検査により米国の女優アンジェリーナ・ジョリーさんが病的バリアントを持っていることが判明し、乳がん・卵巣がんともに発症しやすさが通常の10倍以上になることから、乳房と卵巣を切除したことが話題となりました。世界では、このような遺伝子検査は年間数十万人について行われていると推定されます注2)。
日本においては、これまで検査を受けたのは数千人にとどまっていると推定されています注3)。その理由の一つとして、遺伝子検査結果の解釈に問題があることが挙げられます。乳がんの原因となる11遺伝子を解析すると平均で10個程度の遺伝子バリアント[1]が見つかりますが、その中に乳がんのリスクを大きく高める病的バリアントが存在するか否かを見極めるためには、米国国立生物工学情報センター(NCBI)が提供するClinVar注4)などのデータベースを用いる必要があります。遺伝子バリアントは人種によってその頻度が大きく異なりますが、ClinVarなどのデータベースには日本人の情報が非常に少ないため、日本人で見つかった遺伝子バリアントが病的バリアントであるかどうかの判断が難しい場合が多くあります。PARP阻害剤[3]という薬の投与を決めるため、2018年にこの遺伝子検査に保険が使用できるようになりましたが、適切な投与の判断には、遺伝子バリアントが病的バリアントであるかを科学的に判断する為のエビデンスを蓄積することが不可欠です。
また、遺伝子検査の対象として11遺伝子が米国国立包括がんネットワーク(NCCN)のガイドラインで指定されていますが、非常によく研究されているBRCA1、BRCA2遺伝子とは対照的に、他の遺伝子ではどの人種においても、実際にどの程度疾患のリスクを高めるか明確ではないことも問題となっています注5)。
注1)Hori M, Matsuda T, Shibata A, Katanoda K, Sobue T, Nishimoto H, et al. Cancer incidence and incidence rates in Japan in 2009: a study of 32 population-based cancer registries for the Monitoring of Cancer Incidence in Japan (MCIJ) project. Japanese journal of clinical oncology. 2015;45(9):884-91. 注2)Amanda Ewart Toland et al. Clinical testing of BRCA1 and BRCA2: a worldwide snapshot of technological practices. npj Genomic Medicine volume 3, Article number: 7 (2018) 注3)Yamauchi, H., Okawa, M., Yokoyama, S. et al. High rate of occult cancer found in prophylactic mastectomy specimens despite thorough presurgical assessment with MRI and ultrasound: findings from the Hereditary Breast and Ovarian Cancer Registration 2016 in Japan. Breast Cancer Research and Treatment 2018 注4)米国国立生物工学情報センター(NCBI)が提供するwebページ:ClinVar 注5)Easton DF, Pharoah PD, Antoniou AC, Tischkowitz M, Tavtigian SV, Nathanson KL, Devilee P, Meindl A, Couch FJ, Southey M, Goldgar DE, Evans DG, Chenevix-Trench G, Rahman N, Robson M, Domchek SM, Foulkes WD., Gene-panel sequencing and the prediction of breast-cancer risk. The New England Journal of Medicine 2015, 372, 2243–2257
研究手法と成果
国際共同研究グループはまず、乳がんの原因となる11遺伝子について、バイオバンク・ジャパンにおいて収集された乳がんの疾患群7,051人および対照群11,241人(合計18,292人)のDNAを、理研が独自に開発したゲノム解析手法注6)を用いて調べた結果、1,781個の遺伝子バリアントを同定しました。そして、これらの遺伝子バリアントの登録状況をClinVarで確認したところ、359個(約20%)については病的バリアントか否かについて登録がありましたが、残りは判定不能もしくは未登録でした。
そこで、BRCA1、BRCA2遺伝子の病的バリアントを判定する国際コンソーシアムENIGMAのアマンダ・スパードルグループリーダーとともに、1,781個それぞれの遺伝子バリアントについて病的バリアントか否かの判定を行いました。その際、米国臨床遺伝・ゲノム学会(ACMG)が作成したガイドラインを用いました。このガイドラインでは、各遺伝子バリアントの疾患群・対照群の頻度、IGSR(The International Genome Sample Resource)の1000ゲノムプロジェクト注7)、ExAC(The Exome Aggregation Consortium)注8)、東北メディカル・メガバンク機構が作成したiJGVD注9)といった公開されている遺伝子バリアントの頻度データベース、これまで論文で報告されている遺伝子バリアントの機能解析結果、コンピュータによる機能予測などを組み合わせることで、病的バリアントの判定を行います。
この解析結果とClinVarの情報を統合した結果、今回、同定できた遺伝子バリアント1,781個中244個(約13.7%)が病的バリアントであることが判明しました。その病的バリアント数を遺伝子ごとに見ると図1のようになります。他の人種と同様に日本人においても、BRCA1、BRCA2遺伝子に病的バリアントが最も多く、続いてATM、PALB2、CHEK2遺伝子の順でした。また、同定した244個の病的バリアントの半分以上はClinVarに未登録であり、研究が最も進んでいるBRCA2遺伝子ですら今回同定した病的バリアントの半分以上が新規であることが判明しました。また、ATMやPALB2、CHECK2遺伝子では、今回同定した病的バリアントの約2割程度しか登録されていなかったことも分かりました。
注6)2016年11月11日 理化学研究所プレスリリース「加齢黄斑変性発症に関わる新たな遺伝子型を発見」
注7)IGSR: The International Genome Sample Resource webサイト
注8)ExAC Browser (Beta) | Exome Aggregation Consortium webサイト
注9)Integrative Japanese Genome Variation Database webサイト
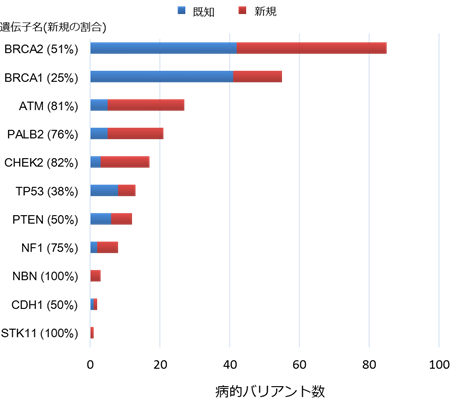
図1 本研究により明らかになった遺伝子ごとの病的バリアント数と既知・新規の割合
次に、遺伝子ごとに病的バリアントのアミノ酸の位置とその頻度を確認するためにロリプロット[4]を作成しました(図2)。その結果、ほとんど(約75%)の病的バリアントは、7,051人の患者群の中で1人しか持っていないという非常に頻度が低いことが分かりました。一方、5人以上で共有する頻度が高い病的バリアントが、ATM遺伝子では1個、BRCA1遺伝子では4個、BRCA2遺伝子では7個見つかりましたが、これらの病的バリアントは他の人種ではほとんど見つかっていませんでした。このことから、病的バリアントは人種差が大きいことが確かめられました。
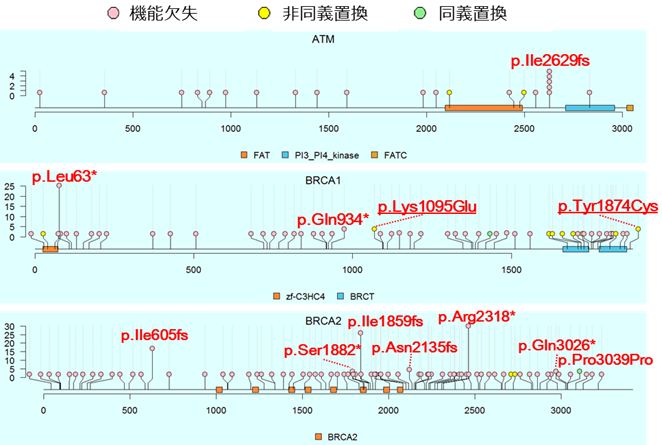
図2 ATM、BRCA1、BRCA2遺伝子に存在する病的バリアントの位置と保有人数
また、これら244個の遺伝的バリアントを患者群・対照群それぞれが、どの程度の割合で持っているか調べたところ、乳がん患者全体では約5.7%、対照群全体では0.6%の人が病的バリアントを持っていることが分かり(表1)、病的バリアントを持つことで乳がんのなりやすさが約10倍高まることが推定できました。このリスクは遺伝子ごとに異なりますが、保有者数の多いBRCA1、BRCA2、PALB2遺伝子についてはそれぞれ約33倍、16倍、9倍であり、おおむね海外で報告されているリスクと同程度でした。
一方で、TP53遺伝子については、海外では100倍以上のリスクと推定されているのに対し、日本人では8.5倍と推定されました。このような差が生じたのは、海外の推定ではTP53遺伝子に病的バリアントを持つことで数種類のがんを多発するリ・フラウメニ症候群[5]の患者・家族の解析結果に基づいているのに対し、本研究では乳がん患者のみから推定されたことが原因だと考えられます。つまり、同じTP53遺伝子の病的バリアントであっても、リ・フラウメニ症候群の原因となる遺伝子バリアントは遺伝子機能への影響が大きく、多くのがんの原因となるが、乳がん患者から得られた遺伝子バリアントの遺伝子機能への影響は相対的に小さく、乳がんの原因にはなるがリ・フラウメニ症候群にはならないと考えられます。
また、乳がん発症との関係が科学的に明確であるとされる11遺伝子であっても、CDH1、NBN、STK11の3つの遺伝子にある病的バリアントが原因だと考えられる乳がん患者は、日本人にはほとんどいないことが判明しました。このことから、日本人に対する遺伝子検査を行う上で、対象とする遺伝子を再評価する必要があることが分かりました。
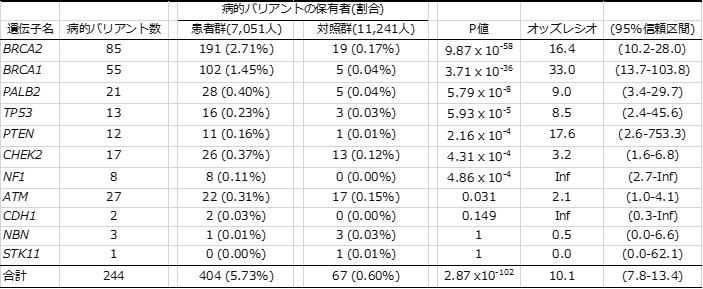
表1 本研究で明らかになった乳がん原因遺伝子別の病的バリアント保有者と疾患リスク
次に、病的バリアント保有者がどのような臨床的特徴を持っているかを、バイオバンク・ジャパンで収集された臨床情報を用いて調べました。その結果、表2に示すように、病的バリアント保有者は非保有者よりも乳がんと診断される年齢が5歳程度若く、卵巣がんを併発しやすく、両乳房に発症しているなど臨床症状が悪く、また家族に乳がん、卵巣がん、膵がん、胃がん、肝臓がん、骨腫瘍、膀胱がん患者がいる割合が大きいことが判明しました。
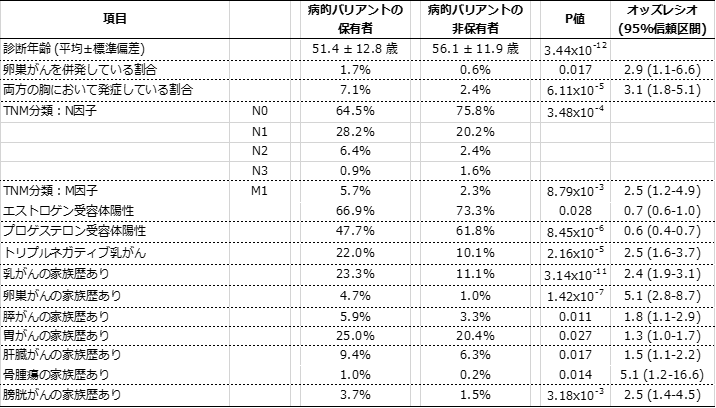
表2 病的バリアント保有者の臨床的特徴
さらに、乳がん診断年齢ごとに病的バリアント保有者の割合を調べたところ、図3のように40歳未満で乳がんと診断された人の約15%が病的バリアントを持っており、年齢区分が上がるごとにその割合は下がっていきました。しかし、80歳以上であっても約3%の人は、病的バリアントが原因で発症していました。一般的に、1カ所の病的バリアントにより発症する遺伝性疾患は早期に発症すると考えられていますが、80歳以上の高齢であっても一定の寄与があり、遺伝子検査をする意義があることが分かりました。
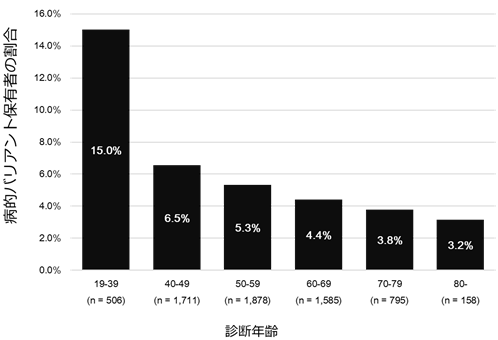
図3 乳がん診断年齢ごとの病的バリアント保有者の割合
最後に、診断年齢に及ぼす影響を遺伝子ごとに解析したところ、BRCA1、BRCA2遺伝子では発症年齢が約5歳若くなり、PTEN遺伝子では20歳も若くなることが分かりました。このため、PTEN遺伝子は病的バリアントの割合は乳がん患者全体では5番目ですが、40歳未満に絞った場合では、BRCA2、BRCA1遺伝子に次いで3番目に多いことが明らかになりました。
本研究で得られた配列データ(fastqファイル)は、バイオサイエンスデータベースセンター(NBDC)に登録しました注10)。NBDCの許可を得れば、今後の研究に自由に使用できます。また、各病的バリアントのサマリー情報は、日本の臨床ゲノム情報統合データベース(MGeND)注11)のほか、ClinVar、BRCA exchange注12)、LOVD注13)から順次公開され、臨床現場における遺伝子バリアントの解釈について重要な情報として利用されます。
注10)NBDCヒトデータベースwebサイト
注11)Medical Genomics Japan Variant Database webサイト
注12)BRCA Exchange webサイト
注13)Leiden Open Variation Database 3.0 webサイト
今後の期待
18,000人以上に及ぶ乳がん患者群・対照群のDNAを用いた世界最大規模の解析により、日本人の乳がん患者における病的バリアント、原因となる11遺伝子の寄与、臨床的特徴が明らかになりました。今後、これらの情報をもとに日本の乳がんにおいて、患者一人一人にあったゲノム医療体制が構築されていくと期待できます。
一方で、BRCA1、BRCA2遺伝子に異常があると、前立腺がん(男性)や膵臓がん(男女)にもなりやすいことが報告されていますが、研究報告の数が少ないため明確ではありません。そのため、今後、他の種類のがんについても同様の手法を用いて大規模解析を行っていくことで、その他のがんについても患者一人一人にあったゲノム医療が可能となると期待できます。
論文情報
- タイトル
- Germline pathogenic variants of 11 breast cancer genes in 7,051 Japanese patients and 11,241 controls
- 著者名
- Yukihide Momozawa, Yusuke Iwasaki, Michael T. Parsons, Yoichiro Kamatani, Atsushi Takahashi, Chieko Tamura, Toyomasa Katagiri, Teruhiko Yoshida, Seigo Nakamura, Kokichi Sugano, Yoshio Miki, Makoto Hirata, Koichi Matsuda, Amanda B. Spurdle, Michiaki Kubo
- 雑誌
- Nature Communications
- DOI
- 10.1038/s41467-018-06581-8
補足説明
- [1] 遺伝子バリアント、病的バリアント
- ヒトのDNA配列は30億の塩基対からなるが、その配列の個人間の違いを遺伝子バリアントという。そのうち、疾患発症の原因となるものを病的バリアントと呼ぶ。
- [2] バイオバンク・ジャパン
- 日本人集団27万人を対象とした、世界最大級の疾患バイオバンク。オーダーメイド医療の実現プログラムを通じて実施され、ゲノムDNAや血清サンプルを臨床情報と共に収集し、研究者へ分譲を行っている。2003年から東京大学医科学研究所内に設置されている。https://biobankjp.org/
- [3] PARP阻害剤
- DNAの相同組換え修復機構が機能していないがん細胞に、特異的に細胞死を誘導する新しい分子標的薬のこと。
- [4] ロリプロット
- 遺伝子バリアントのアミノ酸配列上での位置と保有する人数の関係を示した図。その形が、棒付きの飴(ロリポップ)に似ていることから、ロリプロットと呼ぶ。
- [5] リ・フラウメニ症候群
- 家族性に、軟部組織肉腫、骨肉腫、閉経前乳がん、脳腫瘍、副腎皮質がんなどを多発する遺伝性症候群の一つ。報告は世界で400家系に満たず、非常にまれであり、患者は一般よりも若い年齢でがんを発症するリスクが高い。確認されている原因遺伝子はTP53遺伝子のみである。
発表者・機関窓口
発表者
理化学研究所 生命医科学研究センター 基盤技術開発研究チーム
チームリーダー 桃沢 幸秀(ももざわ ゆきひで)
機関窓口
理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
E-mail:ex-press[at]riken.jp
東京大学大学院新領域創成科学研究科 総務係
TEL : 04-7136-5578 Fax:04-7136-4020
E-mail:k-somu [at] adm.k.u-tokyo.ac.jp
東京医科歯科大学 総務部総務秘書課広報係
TEL : 03-5803-5833 FAX:03-5803-0272
E-mail : kouhou.adm[at]tmd.ac.jp
栃木県立がんセンター ゲノムセンター ゲノムセンター長 菅野 康吉
TEL:028-658-5151 FAX:028-658-5669
昭和大学 総務課(広報担当)
TEL:03-3784-8059
E-mail:press[at]ofc.showa-u.ac.jp
国立がん研究センター 企画戦略局広報企画室
TEL:03-3542-2511 FAX:03-3542-2545
E-mail:ncc-admin[at]ncc.go.jp
徳島大学 総務部総務課(広報担当)
TEL:088-656-7021 FAX:088-656-7012
E-mail:kohokakaricho[at]tokushima-u.ac.jp
医療法人社団メタセコイア FMC東京クリニック
TEL:03-3221-0333
E-mail:info[at]fmctokyo.jp
AMED事業に関するお問い合わせ先
日本医療研究開発機構(AMED) 基盤研究事業部 バイオバンク課
TEL:03-6870-2228
E-mail:kiban-kenkyu[at]amed.go.jp
※上記の[at]は@に置き換えてください。
関連リンク
掲載日 平成30年10月15日
最終更新日 平成30年10月15日


