プレスリリース エストロゲンが骨細胞のSema3Aを介して骨の恒常性を維持するしくみを解明―閉経後骨粗鬆症の新たな治療法の開発に期待―
プレスリリース
国立大学法人 東京医科歯科大学
国立大学法人 東京大学
国立研究開発法人 科学技術振興機構(JST)
国立研究開発法人 日本医療研究開発機構(AMED)
ポイント
- これまで、閉経に伴うエストロゲン欠乏と、それによって誘導される骨粗鬆症(骨粗しょう症)において骨細胞*1の細胞死が誘導されることが知られていましたが、そのメカニズムはよくわかっていませんでした。
- 本研究により、骨細胞が発現する骨保護因子Semaphorin3A(セマフォリン・スリー・エー:Sema3A)*2がエストロゲンによって発現を制御され、そのSema3Aが骨細胞自体に作用して細胞の生存を維持していることが明らかにされました。
- 閉経後骨粗鬆症のさらなる病態解明と、新たな分子機序の治療法開発への応用が期待できます。
概要
東京医科歯科大学大学院医歯学総合研究科分子情報伝達学分野の中島友紀教授と林幹人助教らの研究グループは、東京大学大学院医学系研究科免疫学分野の高柳広教授、同研究科骨免疫学寄付講座、同研究科整形外科学分野の田中栄教授、同研究科ロコモ予防学寄付講座の研究グループとの共同研究で、閉経後骨粗鬆症や加齢での骨量減少の原因が骨細胞でのSema3A発現低下によることを突き止めました。この研究は国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出(研究開発総括:曽我部正博)」における研究開発課題「骨恒常性を司る骨細胞のメカノ・カスケードの解明」(研究開発代表者:中島友紀)、国立研究開発法人科学技術振興機構(JST)の戦略的創造研究推進事業 さきがけ「生体における動的恒常性維持・変容機構の解明と制御(研究総括:春日雅人)」における研究開発課題「運動器の動的恒常性を司るロコモ・サーキットの解明」(研究者:中島友紀)、文部科学省科学研究費補助金、セコム科学技術振興財団、武田科学振興財団等の支援のもとで行われたもので、その研究成果は、国際科学誌「Cell Metabolism」に、2019年1月17日午前11時(米国東部時間)にオンライン版で発表されます。
研究の背景
超高齢社会である日本において、骨粗鬆症患者は推計1200万人を超え、予備軍を含めると2000万人といわれており、増加の一途をたどっています。生体内において、骨は破骨細胞により少しずつ溶かされ(骨吸収)、また骨芽細胞により新たに作られる(骨形成)ことを日々繰り返しています。この過程を骨リモデリングと呼びますが、そのバランスが崩れ、骨吸収の速度が骨形成の速度を上回った場合に骨密度が低下し、骨粗鬆症に至ると考えられています。骨粗鬆症は特に女性に多い病気で、女性ホルモンの一種であるエストロゲンは骨吸収を抑制することが知られています。一方で、エストロゲンは骨芽細胞や骨細胞(骨芽細胞自体が産生する骨の中に埋没して最終分化した細胞で、様々な機能を持つことが報告されている)と呼ばれる細胞の生存を促進することで、骨密度低下の速度を抑える働きがあります。閉経に伴いエストロゲンの分泌が低下すると急激に骨密度が減るため、閉経は主たる骨粗鬆症の要因の一つとなっています。骨密度の低下により骨の強度が低下し、結果的に大腿骨頸部や椎骨の骨折を来すと、寝たきり状態や慢性腰痛の原因となり、QOL(生活の質)を低下させ死亡率を高めることが知られています。しかしながら、これまでの研究において、エストロゲンが骨細胞を介してどのように骨の細胞を調節・統合しているかは不明でした。本研究グループは以前、Sema3Aと呼ばれる可溶性のたんぱく質が、骨形成を促進し骨吸収を抑制することで骨を保護することを報告しましたが、そのたんぱく質の発現制御機序や産生細胞などはよくわかっていませんでした。
研究成果の概要
本研究グループは、様々な細胞外因子で骨細胞を刺激し、Sema3Aの発現を上昇させるかどうかを調べたところ、エストロゲンが濃度依存的に発現増強作用を持つことがわかりました。さらに、様々な解析によって、エストロゲンによるSema3A発現増強作用はSema3aを標的とするマイクロRNAの発現抑制を介して行われていることが明らかになりました。また、実際に閉経後女性におけるSema3A たんぱく質の血中量を調べたところ、閉経前女性の血中量よりも有意に低いことがわかりました。これは、エストロゲンがヒトでもSema3A の遺伝子発現を調節していることを示唆しています。
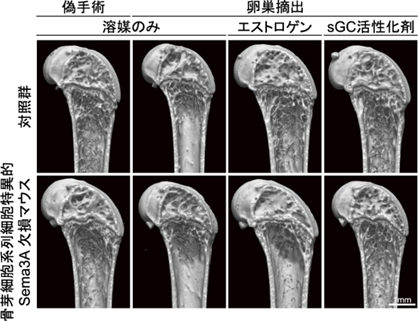
次に、本研究グループは骨芽細胞由来のSema3Aが閉経後骨粗鬆症に及ぼす影響を明らかにするため、骨芽細胞系の細胞で特異的にSema3A遺伝子が欠失したマウスを作出し、その卵巣を摘出することにより閉経後骨粗鬆症モデルとなるマウスを作製しました。これらのモデルマウスにエストロゲンを投与すると、Sema3A遺伝子が欠失したマウスでは骨量維持効果が観察されなかったことから(図1)、骨芽細胞系細胞由来のSema3Aがエストロゲン依存的な骨量維持作用に重要な役割を担っていることがわかりました。
さらに、エストロゲンとともに骨密度の重要な決定要因である加齢におけるSema3A発現量の変化を調べたところ、ヒトでもマウスでも加齢に伴って有意に低下することを見いだしました。そこで、高齢のマウスにおいて骨芽細胞特異的、もしくは骨細胞特異的なSema3A欠損マウスの骨を解析したところ、骨芽細胞特異的Sema3A欠損マウスでは骨量が正常であった一方、骨細胞特異的なSema3A欠損マウスでは加齢に伴って極めて重篤な骨減少症を呈することが明らかになりました。加えて、Sema3Aの受容体であるNeuropilin-1(ニューロピリン・ワン:Nrp1)は骨細胞でのみ欠損したマウスでも同様の重篤な骨減少症を示したことから、高齢マウスにおいては骨細胞が主にSema3Aを産生し、細胞自体や周囲の骨細胞に対して骨量維持作用を発揮している可能性が示唆されました。
また、骨細胞でのみSema3Aが欠損した高齢マウスにおいて、どのような原因で骨量減少に至っているのかを解析したところ、これらのマウスの骨では骨細胞の数が著明に減少していることを見いだしました。実際に、培養骨細胞をSema3Aで刺激すると、可溶型グアニル酸シクラーゼ(sGC)*3活性化が誘導され、環状グアノシン一リン酸(cGMP)を介して細胞の生存シグナルが活性化することがわかりました。さらに、骨芽細胞系列特異的にSema3Aが欠損したマウスの卵巣を摘出した後、sGC-cGMPシグナルを活性化させる薬剤であるsGC活性化剤を投与すると、骨細胞の数が上昇し、卵巣摘出後の骨量減少を抑制させることが明らかになりました(図1)。
これらの結果から、骨細胞から産生されるSema3Aは、特に高齢において重要で、骨細胞自身に発現するNrp1を介して細胞生存維持し、自己制御ループを形成することで骨量の維持に重要な役割を担っていることが明らかになりました(図2)。
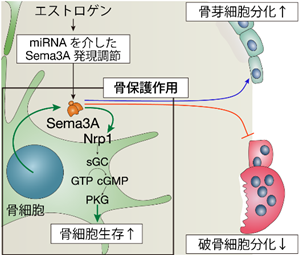
図2 骨細胞のSema3Aを介した自己制御ループによる骨保護作用。
研究成果の意義
本研究成果により、閉経後骨粗鬆症で誘導される骨密度の減少が、閉経前にはエストロゲンによって発現が維持されていたSema3A の発現低下によって引き起こされている可能性が見出されました。この結果から、Sema3AやSema3Aの下流で活性化するsGCを標的とした治療法が、骨細胞の生存を維持することで、骨粗鬆症などの骨関連疾患の治療につながる可能性が示唆されます。今回の報告は、国内外の骨代謝学研究の先導的な意義を持つと考えられ、骨疾患研究が一層進展することが期待されます。
用語説明
- *1骨細胞
- 骨細胞は骨を構成する細胞の約90%の細胞数を占め、骨基質に埋め込まれた特殊な細胞であり、神経細胞様の細胞突起によって骨内の骨細胞同士、そして、骨表面の骨を破壊する破骨細胞や骨を形成する骨芽細胞と密接にコンタクトしている。この細胞間ネットワークは、力学的刺激やホルモンなど生理活性物質の感受・応答を可能とし、骨の恒常性を制御していると考えられている。
- *2 Semaphorin 3A(セマフォリン スリー エー:Sema3A)
- 「セマフォリン」は、「セマドメイン」と呼ばれる特徴的なアミノ酸配列を持つ分子群のたんぱく質であり、元々は神経細胞軸索の行き先を決める分子として発見された。それぞれのセマフォリンには、特異的に結びつくことができるたんぱく質(受容体)が存在し、細胞と細胞の間での情報伝達因子として働き、神経細胞の軸索が伸びる過程に作用することが知られていた。Sema3Aは分泌型のたんぱく質で、Nrp1を介して細胞内に情報を伝達する。これまでの知見で、Sema3Aは免疫系の抑制などにも関与することが分かっている。
- *3可溶型グアニル酸シクラーゼ(sGC)
- 一酸化窒素の受容体で、グアノシン三リン酸を環状グアノシン一リン酸(cGMP)に変換する酵素。生成したcGMPはセカンドメッセンジャーとして機能し、様々なシグナルを活性化する。この酵素の刺激薬は慢性血栓塞栓性肺高血圧症や肺動脈性高血圧症の治療薬として使用されている(本報告では刺激薬ではなく活性化薬を用いた)。
論文情報
- 掲載誌:
- Cell Metabolism
- 論文タイトル:
- Autoregulation of Osteocyte Sema3A Orchestrates Estrogen Action and Counteracts Bone Aging
研究者プロフィール
中島 友紀(ナカシマ トモキ)Nakashima Tomoki
東京医科歯科大学大学院医歯学総合研究科
分子情報伝達学分野 教授
研究領域:骨代謝学、分子生物学
林 幹人(ハヤシ ミキヒト)Hayashi Mikihito
東京医科歯科大学大学院医歯学総合研究科
分子情報伝達学分野 助教
研究領域:骨代謝学、分子生物学
問い合わせ先
研究に関すること
東京医科歯科大学大学院医歯学総合研究科
分子情報伝達学分野 中島 友紀(ナカシマ トモキ)
TEL:03-5803-5472 FAX:03-5803-0193
E-mail:naka.csi"AT"tmd.ac.jp
報道に関すること
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm"AT"tmd.ac.jp
東京大学 医学部総務係
〒113-0033 東京都文京区本郷7-3-1
TEL:03-5841-3304 FAX:03-5841-8585
E-mail:ishomu"AT"m.u-tokyo.ac.jp
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
TEL:03-5214-8404 FAX:03-5214-8432
E-mail:jstkoho"AT"jst.go.jp
JST事業に関すること
科学技術振興機構 戦略研究推進部
川口 哲(カワグチ テツ)
TEL:03-3512-3525 FAX:03-3222-2064
E-mail:presto”AT”jst.go.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
TEL:03-6870-2224 FAX:03-6870-2246
E-mail:kenkyuk-ask"AT"amed.go.jp
E-mailは上記アドレス”AT”の部分を@に変えてください。
掲載日 平成31年1月18日
最終更新日 平成31年1月18日


