軟骨にかかる過剰な力学的負荷が変形性関節症を引き起こすメカニズムの解明
プレスリリース
東京大学
日本医療研究開発機構(AMED)
発表者
張 成虎(東京大学大学院医学系研究科 外科学専攻 形外科学 博士課程(研究当時))
田中 栄(東京大学医学部附属病院 整形外科・脊椎外科 教授)
齋藤 琢(東京大学医学部附属病院 整形外科・脊椎外科 准教授)
発表のポイント
- 軟骨にかかる過剰な力学的負荷が変形性関節症を引き起こすことは古くから知られていましたが、その分子メカニズムは不明でした。今回研究グループは世界で初めてこれを解明しました。
- 過剰な力学的負荷が軟骨を変性させる分子メカニズムとして、Gremlin-1-NF-κBを中心としたシグナル経路を新たに解明しました。
- この経路の中心となるGremlin-1をブロックすると変形性関節症の進行が抑制されることもマウスで証明しており、変形性関節症の治療薬開発に繋がる画期的成果です。
発表概要
変形性関節症は高齢者の健康寿命を脅かす代表的な疾患ですが、進行を止める治療薬はいまだに存在しません。肥満、重労働、関節の外傷など、過剰な力学的負荷が関節軟骨を変性させることは古くから知られていますが、その分子メカニズムは分かっていませんでした。東京大学大学院医学系研究科外科学専攻整形外科学の張成虎大学院生(研究当時)、東京大学医学部附属病院整形外科・脊椎外科齋藤琢准教授らのグループは、細胞や組織に対して周期的に力学的負荷をかける装置を開発し、軟骨細胞において強い負荷によって発現が変化する遺伝子をスクリーニングして、分泌タンパクGremlin-1を同定しました。Gremlin-1は強い力学的負荷によって誘導され、NF-κBシグナル(注1)の活性化を介して軟骨を変性させることなどを、細胞、マウスを用いて証明しました。また、Gremlin-1を標的にすることで変形性関節症の進行を抑制できることも示しました。過剰な力学的負荷が変形性関節症を惹起するメカニズムの全体像を証明したのはこの研究が初めてであり、同時に変形性関節症の本質的な治療法の開発に繋がる成果と考えられます。
本研究は日本医療研究開発機構(AMED)革新的先端研究開発支援事業(PRIME)「メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出」研究開発領域における研究開発課題「ストレス強度に応じた関節軟骨細胞のメカノレスポンスの変容機構の解明」(研究開発代表者:齋藤琢)の支援により行われ、日本時間3月29日に英国科学誌Nature Communications(オンライン版)にて発表されます。
発表内容
変形性関節症(Osteoarthritis, OA)は加齢とともに発症・進行する関節の変性疾患です。膝だけで国内に2,530万人の患者がおり、そのうち780万人が日常的に痛みに苦しんでいます(東京大学ROADスタディ調査、Yoshimura N, et al. J Bone Miner Metab 27:620-8, 2009)。変性した軟骨を元に戻したり、症状の進行を止めたりする薬剤がないことに加え、鎮痛薬による痛みのコントロールが十分でない患者も多くいます。肥満、重労働、関節の外傷など、過剰な力学的負荷がOAの主な原因であることは古くから知られていましたが、その分子メカニズムは分かっていませんでした。この謎を解明し、創薬への糸口を見出すため、東京大学大学院医学系研究科外科学専攻整形外科学の張成虎大学院生(研究当時)、東京大学医学部附属病院整形外科・脊椎外科齋藤琢准教授らのグループは、細胞や組織に対して周期的に力学的負荷をかける装置を開発し、マウスの関節軟骨細胞に強い力学的負荷をかけて、発現が大きく変化する遺伝子をマイクロアレイで探索しました。その中で張、齋藤らは分泌タンパクGremlin-1に注目しました。Gremlin-1はBMP(注2)の作用を抑制する物質(アンタゴニスト)として知られ、四肢の発生に重要な役割を果たすことは報告されていましたが、関節軟骨における作用は知られていませんでした。関節軟骨での発現を調べたところ、Gremlin-1は軟骨の変性とともに関節軟骨深層での発現が著しく増強することが分かりました。またGremlin-1を加えると培養軟骨細胞や培養軟骨組織も量依存的に変性し、軟骨基質分解酵素(軟骨の細胞以外の部分を分解する酵素)の発現が増加し、軟骨基質自体の発現が減少しました。このようなGremlin-1の軟骨に対する作用を生体レベルでも確認するため、骨格成長後のマウスにおいて、遺伝子操作によりGremlin-1を無効化したところOAの進行は有意に抑制されました。またGremlin-1の作用を中和する抗体(中和抗体)をマウスの膝関節内に注射したところOAの進行は同様に有意に抑制されました(図1)。培養細胞を用いた解析も行い、軟骨細胞にかかる力学的負荷がGremlin-1を誘導する経路として、メカノセンサー(注3)としての役割が知られるRac1が活性化して活性酸素の産生増加を促し、それによってNF-κBが活性化されることによりGremlin-1の転写が誘導されることを解明しました。また産生され放出されたGremlin-1は、VEGF受容体(注4)に作用し、NF-κBを活性化することによって下流のOAの制御転写因子HIF-2α(注5)を誘導し、軟骨を変性に至らしめることも証明しました。BMPは軟骨の基質産生を促し、関節に保護的に作用することが知られていますが、Gremlin-1はBMPの基質産生作用を阻害することも明らかとなりました。
このようにこれまで謎に包まれていた、過剰な力学的負荷がOAを引き起こす仕組みの全体像が、本研究によって初めて解明されました(図2)。Gremlin-1がOAの治療標的になりうる可能性はマウスレベルで示されましたが、今回の研究成果の中には標的となりうる分子が他にも数多く含まれており、東京大学医学部附属病院整形外科・脊椎外科の研究グループでは、今後これらを踏まえた創薬研究を加速させていく予定です。
発表雑誌
- 雑誌名:
- 「Nature Communications」(オンライン版:3月29日)
- 論文タイトル:
- Excessive mechanical loading promotes osteoarthritis through the gremlin-1–NF-κB pathway
- 著者:
- Chang SH, Mori D, Kobayashi H, Mori Y, Nakamoto H, Okada K, Taniguchi Y, Sugita S, Yano F, Chung UI, Kanayama JK, Yanagita M, Economides A, Canalis E, Chen D, Tanaka S, and Saito T*
- DOI番号:
- 10.1038/s41467-019-09491-5
用語解説
- (注1)NF-κBシグナル:
- 炎症や免疫反応のほか、細胞の生死、分化など多彩な生命現象を制御するシグナルとして知られている。齋藤らは以前、関節軟骨の恒常性はNF-κBシグナルによって厳密に制御されており、過剰な活性化が変形性関節症に直結することを解明し、報告していた(Nat Commun. 7:13336, 2016)。
- (注2)BMP:
- bone morphogenetic proteinの略で、骨形成を誘導する分泌タンパクとして知られているが、他にも様々な細胞の分化制御に関わることが知られている。軟骨細胞の分化や基質産生にも促進的に作用し、特にBMP-7は関節軟骨に保護的に作用することが知られている。Gremlin-1はBMPの作用を抑制するアンタゴニストとして有名である。
- (注3)メカノセンサー:
- 細胞には、外からかかる様々な刺激を感知する仕組みが備わっている。そのうち、特に力学的負荷の感知機構を総称してメカノセンサーと呼んでおり、これまでに細胞骨格や膜タンパクなど多くの分子が同定されている。
- (注4)VEGF受容体:
- VEGFはvascular endothelial growth factorの略で、血管新生を誘導するサイトカインである。VEGFの受容体にはいくつかの種類が知られているが、逆にVEGF受容体はVEGF以外のサイトカインとも結合しうることが知られている。今回Gremlin-1の受容体として作用していたのはVEGF受容体2型であった。
- (注5)HIF-2α:
- hypoxia inducible factor(HIF)と呼ばれる、低酸素下で作用する転写因子ファミリーに属する分子であるが、その代表格HIF-1αと比べると酸素濃度による影響は少ないとされる。齋藤らは以前、HIF-2αが軟骨変性および変形性関節症の鍵を握る転写因子であることを発見し、NF-κBがHIF-2αを誘導する上流シグナルであることを解明し、報告していた(Nat Med. 16:678-86, 2010)。
添付資料
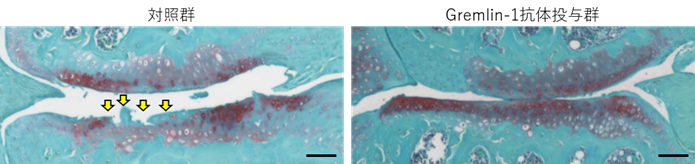
図1:中和抗体投与による変形性関節症の改善
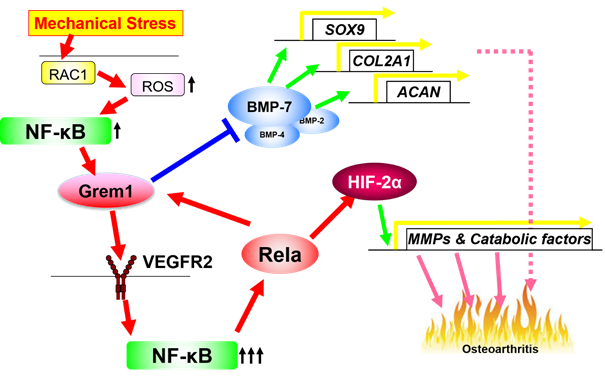
図2:軟骨細胞にかかる過剰な力学的負荷が関節軟骨を変性させる分子メカニズム
Grem1:Gremlin-1
VEGFR2:VEGF受容体2型
Rela:NF-κBの中核をなす転写因子
SOX9:軟骨細胞の鍵を握る転写因子であり、軟骨基質の産生を広く司っている
COL2A1:2型コラーゲン(代表的な軟骨基質の1つ)
ACAN:アグリカン(代表的な軟骨基質の1つ)
問い合わせ先
研究内容に関するお問い合わせ先
東京大学医学部附属病院 整形外科・脊椎外科
准教授 齋藤 琢(さいとう たく)
TEL:03-5800-8656(直通) FAX:03-3818-4082(直通)
E-mail:tasaitou-tky"AT"umin.ac.jp
広報担当者連絡先
東京大学医学部附属病院
パブリック・リレーションセンター(担当:渡部、小岩井)
TEL:03-5800-9188(直通)
E-mail:pr"AT"adm.h.u-tokyo.ac.jp
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
TEL:03-6870-2224 FAX:03-6870-2246
E-mail:kenkyuk-ask"AT"amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成31年3月29日
最終更新日 平成31年3月29日


