プレスリリース ヒトiPS細胞から機能的な視床下部-下垂体ユニットを作製―再生医療や疾患研究に貢献―
プレスリリース
名古屋大学
日本医療研究開発機構
名古屋大学大学院医学系研究科糖尿病・内分泌内科学の笠井 貴敏 客員研究員(筆頭著者)、須賀 英隆 准教授(責任著者)および有馬 寛 教授らの研究グループは、ヒト人工多能性幹細胞(ヒトiPS細胞)※1を用い、成熟した機能的な下垂体ホルモン産生細胞を作製する方法を確立しました。
下垂体はさまざまなホルモンを分泌する内分泌器官です。周囲の環境に応じてホルモンを調節し分泌しており、全身の恒常性を保つために重要な役割をしています。下垂体が機能しなくなると不足したホルモンによりさまざまな症状が出現し、特に副腎皮質刺激ホルモン(ACTH)※2の不足が起こると生命の危機に陥ることもあります。
本研究グループは2016年にヒト胚性幹細胞(ヒトES細胞)※1から下垂体ホルモン産生細胞を作製可能にしていました。今回この方法を改良することにより、ヒトiPS細胞からの作製に成功しました。それに加えて今回は、1つの組織の中に下垂体ホルモン産生細胞と視床下部※3ホルモン産生細胞が共存している組織(視床下部-下垂体ユニット)の作製にも成功しました。このユニットが共存することにより、下垂体ホルモンの分泌能力が向上し、マウス成体の下垂体ホルモン産生細胞と同等レベルになりました。また、視床下部-下垂体ユニットを低グルコース液※4に浸したところACTHが分泌されました。これは低グルコースに対して視床下部と下垂体が協働していることを示唆しており、今回作製できた視床下部-下垂体ユニットが周囲の環境に反応する機能的な細胞組織(オルガノイド)であると考えられました。
本研究の成果は下垂体の機能が低下した患者に対する再生医療の実現に向けた研究を加速させるだけでなく、下垂体と視床下部に関連した疾患の病態研究などにも役立つと考えられます。
本研究は国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム「ヒト多能性幹細胞を用いた下垂体機能低下症に対する再生医療の技術開発」「ヒトiPS細胞を用いた視床下部-下垂体ホルモン産生細胞の分化誘導法と移植方法の開発」「疾患モデル高度化による視床下部・下垂体難病研究」(研究開発代表者:須賀英隆)や、文部科学省科学研究費助成事業のサポートを受けて実施され、英国科学誌『Cell Reports』誌に掲載されます(2020年1月7日(米国東部標準時11時))
ポイント
- ヒトiPS細胞から下垂体ホルモン産生細胞の作製に成功した。
- 下垂体に隣接する視床下部の影響で、下垂体細胞のホルモン分泌能力が飛躍的に向上した。
- 視床下部と下垂体が機能的に連携する仕組みを再現可能とし、低血糖など周囲の環境に反応する機能的な組織となった。
- この方法を応用することで、下垂体機能低下症への再生医療や、視床下部-下垂体に関連する疾患の研究に貢献することが期待される。
背景
下垂体はさまざまなホルモンを制御する司令塔とも言うべき中心的な働きをしており、成長・代謝・ストレス反応など多岐にわたる生命現象をコントロールするのに重要な役割を担っています。下垂体ホルモン産生細胞の機能が低下するとさまざまな症状が出現し、特に副腎皮質刺激ホルモン(ACTH)が低下すると副腎不全を起こし生命の危機に陥ることもあります。現在、下垂体ホルモン産生細胞の機能低下に対する根治療法は存在せず、不足しているホルモンを投与する補充療法が行われています。しかしながら、現行の補充治療では変動するホルモン必要量に対して十分対応できない問題点があり、補充するホルモンの不足による副腎不全やホルモン過剰による糖尿病や高血圧の発生リスクが存在します。もし生体と同じように周囲の環境に応答できるホルモン産生細胞が作製できれば、より高度な恒常性が維持でき、これまでの補充療法よりも優れた治療法になる可能性があります。本研究グループは2016年にヒト胚性幹細胞(ヒトES細胞)から下垂体ホルモン産生細胞を作製することに成功していました。今回この培養方法を用い、ヒト人工多能性幹細胞(ヒトiPS細胞)からの作製を試みました。
研究成果
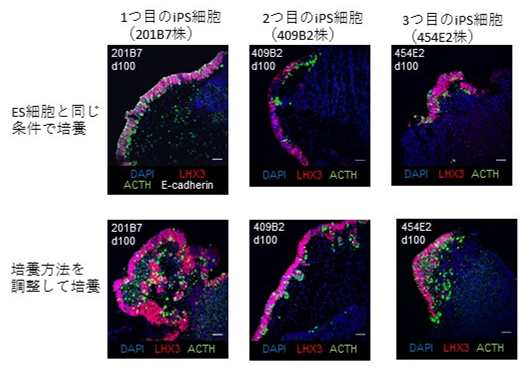
3種類のヒトiPS細胞を培養し、ACTHを産出する細胞を作製することに成功しました。また、作製の効率に影響を及ぼす因子として培養開始時の細胞数や試薬の濃度などを同定し、それぞれヒトiPS細胞に適用しました。(図1)
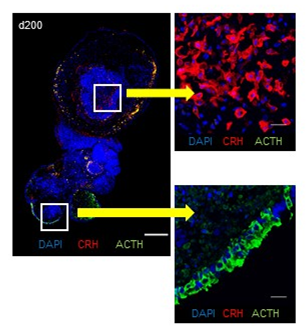
作製の過程では視床下部のもととなる細胞も同時に出現しており、これらを隣接させた状態で150~200日程度の長期の培養を行ったところ、1つの組織の中に下垂体ホルモン産生細胞と視床下部ホルモン産生細胞が共存している組織(視床下部-下垂体ユニット)を作製できました。下垂体の組織内にはACTHを産出する細胞があり、視床下部の組織内には副腎皮質刺激ホルモン放出ホルモン(CRH)※5などの視床下部ホルモンを産出する細胞が存在しました。(図2)
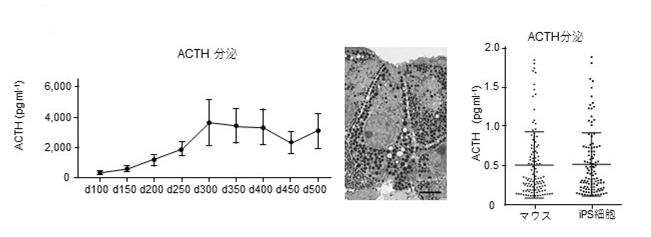
視床下部-下垂体ユニットを更に長期に培養することで、ホルモンの分泌能力が向上しました。さらに、電子顕微鏡では、ACTHを含む分泌顆粒を豊富に蓄えた下垂体細胞が作製できていることを確認しました。1細胞あたりのACTHの分泌量を測定したところ、成体マウスの下垂体ホルモン産生細胞と同等の分泌能力を示すところまで能力が向上していました。(図3)
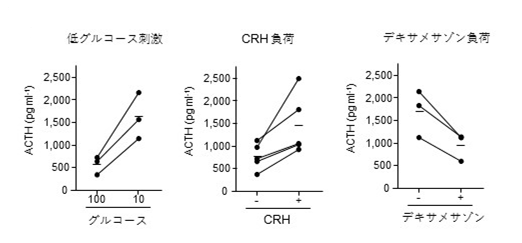
また、視床下部-下垂体ユニットを低グルコース液に浸したところ、ACTHの分泌亢進が確認できました。生体において下垂体は、視床下部から分泌されるCRHの制御を受けて働いています。この実験結果は低グルコースに対して視床下部と下垂体が連携して働いていることを示唆しています。CRHの投与に対してACTHは上昇、デキサメサゾン※6の投与に対してACTHは低下し、視床下部-下垂体ユニットが周囲の環境に反応する機能的な組織、すなわちオルガノイドになっていると考えられました。(図4)
今後の展開
ヒトiPS細胞から機能性を有した下垂体を作製できたため、下垂体の機能が低下した患者に対する再生医療に応用できることが期待されます。また、下垂体と視床下部の両方を有した組織を試験管内で再現できているため、下垂体と視床下部の関連を解明する上でのモデルとしても期待でき、下垂体疾患の発症メカニズムの解明にも役立つと考えられます。
用語説明
- ※1.胚性幹細胞(ES細胞)・人工多能性幹細胞(iPS細胞)
- 胚性幹細胞(ES細胞)とは発生初期の動物胚に存在する内部細胞塊から作られる細胞で,あらゆる種類の体細胞へ分化する能力とほぼ無限に増殖する能力を合わせ持つ多能性幹細胞の1つである。人工多能性幹細胞(iPS細胞)は皮膚や血液などの体細胞に遺伝子を導入することによって得られる多能性幹細胞である。
- ※2.副腎皮質刺激ホルモン(ACTH)
- 下垂体から分泌されるホルモンの一つ。視床下部からの副腎皮質刺激ホルモン放出ホルモン(CRH)により分泌が刺激される。デキサメサゾンなどの糖質コルチコイドで分泌が抑制される。副腎皮質に作用し副腎皮質ホルモンの分泌を促進する。
- ※3.視床下部
- 内分泌や自律神経機能の調節を行う中枢。体温・睡眠・食欲など、多岐にわたる生命現象をコントロールするのに重要な役割を担う。下垂体をコントロールする働きも受け持っている
- ※4.低グルコース液
- グルコース(ブドウ糖)の濃度を低下させた液体。生体内で血液中のグルコースが低値になると、視床下部が感知し、情報が下垂体へと伝わって、ACTHの分泌が亢進する。
- ※5.副腎皮質刺激ホルモン放出ホルモン(CRH)
- 視床下部から分泌されるホルモンの一つ。生体では、下垂体に作用してACTHの分泌を促進する。
- ※6.デキサメサゾン
- 糖質コルチコイド、あるいはステロイドなどと呼ばれる薬剤の一つ。生体にデキサメサゾンを投与すると、ネガティブフィードバックと呼ばれる作用を介して、下垂体からのACTH分泌が抑制される。
発表雑誌
- Department of Endocrinology and Diabetes, Nagoya University Graduate School of Medicine, Nagoya 466-8550, Japan.
- Division of Diabetes and Endocrinology, Department of Internal Medicine, Kobe University Graduate School of Medicine, Kobe 650-0017, Japan.
- Department of Physiology, Fujita Health University, Toyoake 470-1192, Japan. 4Department of Diagnostic Pathology, Toranomon Hospital, Tokyo 105-8470, Japan 5Department of Clinical Application, Center for iPS Cell Research and Application, Kyoto University, Kyoto 606-8507, Japan
- 掲雑誌名:
- Cell Reports (米国時間1月7日付の電子版)
- 論文タイトル:
- Hypothalamic Contribution to Pituitary Functions is Recapitulated in vitro Using 3D-cultured Human iPS Cells
- 著者:
- Takatoshi Kasai1, Hidetaka Suga1, Mayu Sakakibara1, Chikafumi Ozone1, Ryusaku Matsumoto2, Mayuko Kano1, Kazuki Mitsumoto1, Koichiro Ogawa1, Yu Kodani3, Hiroshi Nagasaki3, Naoko Inoshita4, Mariko Sugiyama1, Takeshi Onoue1, Taku Tsunekawa1, Yoshihiro Ito1, Hiroshi Takagi1, Daisuke Hagiwara1, Shintaro Iwama>1, Motomitsu Goto1, Ryoichi Banno1, Jun Takahashi5 & Hiroshi Arima1
- 所属:
-
- Department of Endocrinology and Diabetes, Nagoya University Graduate School of Medicine, Nagoya 466-8550, Japan.
- Division of Diabetes and Endocrinology, Department of Internal Medicine, Kobe University Graduate School of Medicine, Kobe 650-0017, Japan.
- Department of Physiology, Fujita Health University, Toyoake 470-1192, Japan.
- Department of Diagnostic Pathology, Toranomon Hospital, Tokyo 105-8470, Japan
- Department of Clinical Application, Center for iPS Cell Research and Application, Kyoto University, Kyoto 606-8507, Japan
お問い合わせ先
研究について
名古屋大学医学系研究科
糖尿病・内分泌内科学 准教授 須賀 英隆
TEL:052-744-2142 FAX:052-744-2211
E-mail:sugahide“AT”med.nagoya-u.ac.jp
広報担当
名古屋大学医学部・医学系研究科総務課総務係
TEL:052-744-2228 FAX:052-744-2785
E-mail:iga-sous“AT”adm.nagoya-u.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 再生医療研究課
TEL:03-6870-2220 FAX:03-6870-2242
E-mail:saisei“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年1月8日
最終更新日 令和2年1月8日


