プレスリリース 老年期うつ病を引き起こす可能性のある異常タンパク質を生体内で可視化―老年期うつ病の治療・予防に光明が見えた!―
プレスリリース
国立研究開発法人量子科学技術研究開発機構
慶應義塾大学医学部
国立研究開発法人日本医療研究開発機構
発表のポイント
- 認知症の原因物質と考えられるタウタンパク質1)(以下、タウ)が、高齢で発症するうつ病(老年期うつ病2))で脳内に蓄積することを、生体イメージングで世界に先駆けて明らかにした
- 老年期うつ病患者では、大脳皮質にタウが蓄積し、特に精神病症状3)を認める患者では蓄積が顕著であることから、大脳皮質へのタウ蓄積が精神症状を引き起こす可能性が示された
- タウを生体脳で可視化する技術は、老年期うつ病の診断に有用であるのみならず、病態解明とそれに基づく新しい治療戦略の確立に有用と期待される
発表概要
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫、以下「量研」)量子医学・医療部門放射線医学総合研究所脳機能イメージング研究部の森口翔客員研究員(主所属:慶應義塾大学医学部精神・神経科学教室)と樋口真人部長らは、慶應義塾大学医学部精神・神経科学教室の三村將教授らとの共同研究により、老年期うつ病患者の生体脳に蓄積するタウを可視化し、その蓄積がうつ症状の発症と関連している可能性があること、さらにその蓄積量が老年期うつ病でみられる精神病症状の有無と関連していることを明らかにしました。
これまでうつ病には客観的な診断法が存在せず、主に問診で確認した臨床症状から評価することで診断されてきましたが、その症状や病態についても多様で不明な点も多く、治療の効果も限定的でした。また、うつ病はアルツハイマー型認知症4)はじめとした認知症の危険因子であることが知られていましたが、うつ病と認知症に共通する病態メカニズムについては十分にはわかっていませんでした。
これまでに報告されているうつ病患者の死後脳を用いた研究では、認知症患者の脳内に蓄積し、神経障害の発現に関与していると考えられているタウやアミロイドβタンパク質5)(以下、アミロイドβ)などの異常タンパク質が、一部のうつ病患者の脳内においてもみられることが明らかになっています。このことから、認知症患者と同様にうつ病患者においても、これらの異常タンパクの脳内蓄積が病気の発症に関与している可能性が疑われてきましたが、臨床症状との関連については明確な証拠は得られていませんでした。
本研究では、量研が世界に先駆けて開発した生体脳でタウを可視化するポジトロン断層撮影(PET)6)技術を用いて、老年期うつ病患者のタウおよびアミロイドβの脳内蓄積量を非侵襲的に測定し、臨床症状との関連について検討しました。その結果、同年代の健常高齢者と比べて一部の老年期うつ病患者においては大脳皮質7)全体におけるタウ蓄積が有意に多く、特に妄想や幻聴といった精神病症状を認める患者では脳内タウ蓄積量が顕著であることを明らかにしました。
これらの成果は、PETにより捉えた生体脳におけるタウ蓄積を指標として、老年期うつ病の客観的な診断が可能になることを示すものであり、さらに認知症の根本治療薬として開発が行われている脳内タウ蓄積を抑制する新規治療薬が老年期うつ病においても有効である可能性が期待されます。
本研究は、日本医療研究開発機構(AMED)「臨床と基礎研究の連携強化による精神・神経疾患の克服(融合脳)」の支援を受けて実施されました。この成果は精神医学分野においてインパクトの大きい(インパクトファクター8)11.973)国際的な学術誌である『Molecular Psychiatry』のオンライン版に、2020年7月1日(水)9時00分(日本時間)に掲載されます。
研究開発の背景
精神疾患は、5大疾病(他4疾病は、がん、脳卒中、糖尿病、急性心筋梗塞)のひとつであり、医療機関にかかっている患者数は近年大きく増加しています。その中でもうつ病は最も多い疾病であり自殺のリスクもあることから対策が求められていますが、症状や病態が多様で、患者ごとに異なるため画一的な対応では治療が困難な場合も少なくありません。その中でも老年期うつ病は自殺率が高く、対策が必要な重要な問題となっています。
老年期うつ病は、アルツハイマー型認知症をはじめとした認知症の危険因子であることが知られています。また、認知症の約3割はその発症前に何らかの精神疾患であると診断されていますが、その多くはうつ病が占めています。このようにうつ病と認知症には共通点がみられるものの、老年期うつ病と認知症の間にある共通した病態メカニズムについてはさまざまな仮説が提唱されてきたものの、これまではっきりとはわかっていませんでした。その中のひとつの仮説として、タウやアミロイドβの蓄積はこれら2つの疾患に共通している可能性が言われており、死後脳を用いた研究でもそれらの存在が示唆されてきました。
そこで、これまで老年期うつ病の脳内においても神経変性疾患と同様の変化が起こっているかを確認するため、PETを用いた脳内のアミロイドβ蓄積の探索がなされてきました。しかし、うつ病におけるアミロイドβの蓄積は、ある程度認知機能の低下した軽度認知障害をともなううつ病では認められたものの、認知機能の保たれたうつ病ではアミロイドβの蓄積に関して一貫した結果を得られていませんでした。また、タウとアミロイドβ両方に結合するイメージング剤18F-FDDNP9)で行われた老年期うつ病のPET研究では、うつ病の脳内で18F-FDDNPの結合が高く認められたものの、それがタウ蓄積によるものなのかアミロイドβ蓄積によるものかは不明のままでした。
われわれはこれまでに、量研が開発したPETにより生体脳でタウを特異的に可視化する技術を用いて、アルツハイマー型認知症(2018年6月8日プレスリリース)や、特定地域で多発する認知症(2018年12月8日プレスリリース)、前頭側頭型認知症(2019年2月18日プレスリリース)、進行性核上性麻痺患者(2019年3月27日プレスリリース)、頭部外傷(2019年9月2日プレスリリース)などさまざまな疾患を対象に、タウ蓄積と病態の関係などを明らかにしてきました。そこで本研究では、この技術を用いて、老年期うつ病を対象にタウならびにアミロイドβの蓄積量ならびに分布と、臨床的特徴との関連を明らかにする研究を行いました。
研究の手法と成果
本研究では、50歳以上の老年期うつ病20名と同年代の健常者20名の協力により得られたデータを解析の対象としました。老年期うつ病の患者は慶應義塾大学病院およびその関連施設にて募集し、健常者は量研のボランティア募集システムを介して募集しました。なお、老年期うつ病の患者群は操作的診断基準10)でうつ病と診断され、認知機能が保たれている患者を対象としました。そのうちの10名は妄想や幻聴などの精神病症状を認めました。
これらの方々を対象に、タウに対しては量研が開発したイメージング剤11C-PBB311)を用いて、アミロイドβに対してはイメージング剤11C-PiBを用いてPET検査を行い、タウおよびアミロイドβの脳内の各領域における蓄積量を調べました。その結果、老年期うつ病患者では脳内の大脳皮質全体にタウ蓄積が認められ、その中でも前帯状皮質と呼ばれる脳部位で高い傾向がみられました(図1、図2)。また、患者内において精神病症状の有無で分けて比較したところ、精神病症状を有する老年期うつ病患者群の大脳皮質全体においてタウ蓄積がより多く認められ、特に前頭前皮質、前帯状皮質、側頭葉などの脳部位で高い傾向がみられました。過去の研究では、精神病症状をともなううつ病において、前頭前皮質、前帯状皮質、側頭葉で、脳体積の減少や血流低下が認められています。
なお、アミロイドβの蓄積量は、老年期うつ病患者群と健常者群で差はありませんでした。
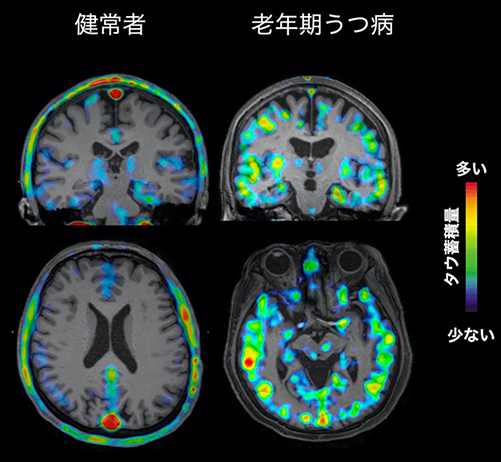
色のついているところがタウ蓄積のある部位であり、タウの量は図中のスケールバーの通り少ない(青色)→多い(赤色)で示されます。
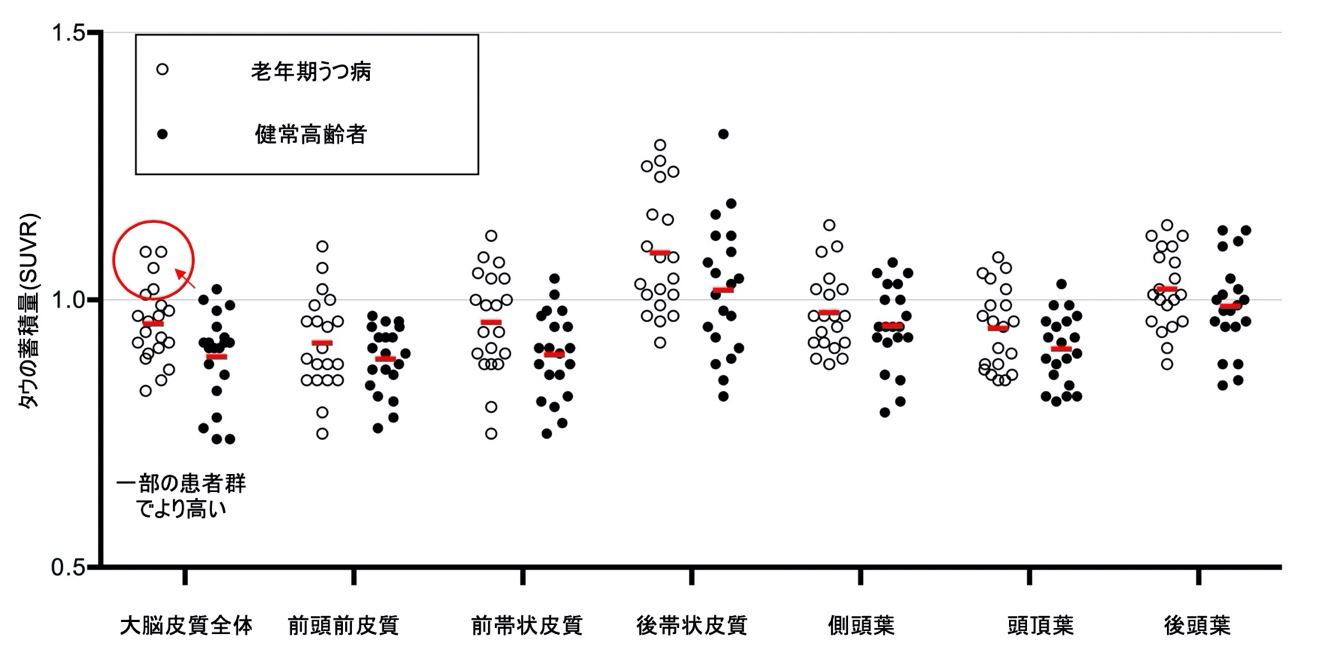
次に本研究結果を検証するため、東京都健康長寿医療センターで行われた高齢者ブレインバンクプロジェクトの死後脳データにアクセスし、臨床評価スケールによって抑うつ症状を呈した症例、もしくは、過去にうつ病と診断された既往のある症例にタウの蓄積が認められるかどうかを確認しました。その結果、顕著なアミロイドβの蓄積がないもののタウの蓄積が認められるケースが、抑うつ症状が認められた20症例中7例、うつ病の既往があった24症例中6症例でみられることが明らかになりました。これにより、PET検査による結果と同様にうつ病患者の一部にタウ蓄積が関連している可能性が死後脳でも示唆されました。
今後の展開
本研究の成果は、一部の老年期うつ病、特に精神病症状を呈する患者にタウの蓄積が関与している可能性を示唆しました。
これまでの操作的診断基準では、若年者のうつ病も老年期うつ病も、同じひとつのうつ病として診断され、治療方法も同一のものでした。しかし、臨床上はこれら2つのうつ病が明らかに異質な症状を呈している場合が少なくありません。その中でも、妄想や幻覚などを呈する精神病症状は老年期うつ病に比較的多く認められ、若年者にはほとんど認められないことが知られています。こうした老年期うつ病に比較的特有な精神病症状としては、うつ病の一群としても考えられるコタール症候群12)などがあります。このような臨床的観察により、以前から老年期うつ病の中には若年者とは別のメカニズムが関与しているのではないかと言われていました。
本研究の結果はそのような精神病症状を呈する老年期うつ病にタウ蓄積が関与していることを示唆するものです。一方で、本研究において精神病症状を呈する老年期うつ病であってもタウ蓄積が認められない症例も認められたため、今後、精神病症状が認められたとしてもどのような場合にタウ蓄積が関連しているかを明らかにするための研究が必要となります。
また、本研究の成果は診断のみではなく、老年期うつ病の今後の治療指針についても有用である可能性があります。アルツハイマー病などの認知症では、タウ蓄積を標的とした根本的な治療薬の開発と複数の臨床試験が実施されており、われわれも治療薬の開発研究を行っています(2018年8月29日プレスリリース)。タウが関与している一部の老年期うつ病を早期に診断することが可能となれば、こうした新しい治療法を適用できるようになると期待されます。
現在われわれは、老年期うつ病の診断精度を高めるために、生体内のタウを可視化する技術を改良する研究を進めています。また、本研究ではブレインバンクデータを利用し、うつ病の既往とタウ蓄積との関連を検証しましたが、PETの所見と死後脳の検査結果とを直接比較する画像病理相関による検証を行うことで診断精度を向上させることが期待できます。こうした取り組みにより、老年期うつ病に対する診断・治療法の開発を加速させたいと考えています。
このプレスリリースは『Molecular Psychiatry』のオンライン版に掲載される「Moriguchi S, et al. Excess tau PET ligand retention in elderly patients with major depressive disorder: a PET study (邦題:老年期うつ病においての過剰なタウ蓄積を検証したPET研究)」に基づいて作成されています。
用語解説
- 1)タウタンパク質
- 神経系細胞の骨格を形成する微小管に結合するタンパク質。細胞内の骨格形成と物質輸送に関与しています。アルツハイマー型認知症をはじめとするさまざまな精神神経疾患において、タウが異常にリン酸化して細胞内に蓄積することが知られています。
- 2)老年期うつ病
- 気分の落ち込み、喜び・意欲の喪失、食欲低下、不眠などを呈する精神疾患であるうつ病の中で高齢者に起こった場合を指します。年齢等については諸説あり定まったものはないが、本研究においては50歳以降においてうつ病を発症した方を対象としました。
- 3)精神病症状
- 実態がなく他人には認識できない音が聞こえたり、物が見えたりする「幻聴」や「幻視」、また、明らかに誤ったあり得ない内容を信じてしまい訂正が困難である「妄想」といった症状。
- 4)アルツハイマー型認知症
- 認知症の原因として最も多い病気。脳内に異常タウタンパクやアミロイドβが蓄積して、進行性に物忘れなどが目立つ認知機能障害が出現します。
- 5)アミロイドβタンパク質(Aβ)
- アルツハイマー病やダウン症候群にみられる病理学的変化ではる老人班、脳アミロイド血管症(アミロイドアンギオパチー)の主成分の一つ。Aβ自身も神経細胞に毒としての作用を及ぼすことが報告されています。
- 6)PET(Positron Emission Tomography)
- ポジトロン断層撮影の略称。身体の中の生体分子の動きを生きたままの状態で外から見ることができる技術の一種。特定の放射性同位元素で標識したPET薬剤を患者に投与し、PET薬剤より放射される陽電子に起因するガンマ線を検出することによって、体深部に存在する生体内物質の局在や量などを三次元的に測定できます。
- 7)大脳皮質
- 大脳皮質は、脳や脊髄において神経細胞の細胞体が多数集まる部位であり、脳の表層部に位置しています。大脳皮質は灰白質とも呼ばれますが、灰白質という名前は、脳の断面を肉眼的に観察した際に灰色がかって見えることに由来します。大脳皮質には前頭前皮質、前帯状皮質、側頭葉などが含まれます。
- 8)インパクトファクター
- 学術雑誌の影響度を評価する指標の一つ。その雑誌に掲載された論文がある期間内にどの程度引用されたかを平均値で示したもので、数値が大きいほどその雑誌の影響度が大きいと判断されます。今回示したものは2018年のデータをもとに計算された最新の値で、精神科領域では146雑誌中6位、神経科学領域では267雑誌中10位です。
- 9)18F-FDDNP
- 2-(1-{6-[(2-[18F]fluoroethyl)(methyl)amino]-2-naphthyl}ethylidene)malononitrileの略称。カリフォルニア大学ロサンゼルス校で開発された薬剤。アミロイドβとタウを可視化できますが、タウへ特異的・選択的でなく、解釈に注意が必要です。
- 10)操作的診断基準
- 精神神経疾患は、臨床症状や他覚的所見の組み合わせが多彩であるため、評価を行う医師によって診断が異なることが少なくない。そのため、精神神経疾患の診断には、評価者によって違いが生じないように臨床症状や他覚的所見を項目化し、一定の基準を設けて診断できるように作成された基準を用いる。操作的診断基準は、診断の精度や一致率などの検証がなされ、定期的に改定されている。
- 11)11C-PBB3
- 量研が開発した、脳内に蓄積したタウに対して選択的に結合する薬剤。PBB3のPBBはPyridinyl-Butadienyl-Benzothiazoleの略称。蛍光物質であることから、生体蛍光画像を得るのにも利用できるが、PBB3を放射性同位元素で標識することにより、PET薬剤として使用できる。生体蛍光画像は細胞レベルの詳細な観察を可能にするが、脳の深部を観察することは困難である。PETは脳の深部観察を可能にし、ヒトにも応用可能である。
- 12)コタール症候群
- 主に人生の後半期に起こり、不安や抑うつ症状に伴い「自分には脳や腸が腐ってしまって無い」といった存在するはずのものが存在しないという否定妄想が精神病症状のひとつとして認められる症候群。
お問い合わせ先
研究内容について
国立研究開発法人量子科学技術研究開発機構 量子医学・医療部門
放射線医学総合研究所 脳機能イメージング研究部
客員研究員 森口翔 TEL:043-206-4697 E-mail:moriguchi.sho“AT”gmail.com
部長 樋口真人 TEL:043-206-4700 E-mail:higuchi.makoto“AT”qst.go.jp
報道対応
国立研究開発法人量子科学技術研究開発機構
経営企画部 広報課 中禎弘 TEL:043-206-3026 FAX:043-206-4062
慶應義塾大学 信濃町キャンパス総務課 鈴木・山崎 TEL:03-5363-3611 FAX:03-5363-3612
AMED事業について
国立研究開発法人日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課 TEL:03-6870-2225 E-mail:brain-pro“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和2年7月1日
最終更新日 令和2年7月1日


