プレスリリース HBV感染細胞から放出される細胞外小胞は、HBV感染マウスモデルにおいてHBV排除を抑制する
プレスリリース
学校法人東海大学
国立研究開発法人日本医療研究開発機構
研究のポイント
- B型肝炎ウイルス(Hepatitis B virus:HBV)(注1)感染細胞から放出される細胞外小胞(Extracellular vesicles:EVs)(注2)を、HBV感染マウスモデルに投与したところ、HBVの排除が抑制されることが明らかになりました。
- HBV感染細胞由来EVsを投与したHBV感染マウスモデルの肝臓所属リンパ節において、免疫チェックポイント因子の一つであるPD-L1(注3)陽性の樹状細胞(注4)の割合が増加することが明らかになりました。
- HBV感染細胞由来EVsを介した肝臓―骨髄―腸連関が存在することが明らかになりました。
発表概要
東海大学医学部基盤診療学系先端医療科学の柿崎正敏特任助教、幸谷愛教授らの研究グループはHBV感染マウスモデルを用いて、HBV感染細胞から放出されるEVsがHBV排除を抑制することを明らかにしました。
本研究グループは、以前の研究でHBV感染細胞由来EVsを取り込んだ単球系細胞(樹状細胞、単球/マクロファージ)でPD-L1の発現が上昇することを示しました。また、HBVの排除にはHBV特異的CD8+ T細胞(注5)が重要であることから、T細胞の抑制に関与するPD-L1の発現を単球系の細胞を中心に解析しました。その結果、HBV感染細胞由来EVs投与群では肝臓所属リンパ節において、PD-L1陽性の樹状細胞の割合が増加していることが明らかになりました。さらに、HBV感染細胞由来EVsを介した肝臓−骨髄−腸連関が存在することが明らかとなり、HBV感染細胞由来EVsは腸管にも何らかの影響を与えていることが示唆されました。本研究結果は、HBVの持続感染(注6)のメカニズムの一端を明らかにしたものであり、さらにHBV感染細胞由来EVsが腸管へも何かしらの影響を与えている可能性を示唆していることから、B型肝炎の病態解明への一助になる成果であると考えられます。
本研究成果は、日本時間2020年8月28日午後1時(米国東部時間時間2020年8月28日午前0時)公開のJournal of Biological Chemistry誌にオンライン公開される予定です。
なお、本研究は、国立研究開発法人日本医療研究開発機構(AMED)の肝炎等克服緊急対策研究事業「B型肝炎に関する病態生理の新たな解明に基づく制御法開発(研究開発代表者:大塚基之)」、および文部科学省科学研究費補助金若手研究「腸内細菌叢の構成変化に対するHBV感染細胞由来細胞外小胞の役割の検討」(研究代表者:柿崎正敏、課題番号:18K15131)の支援により行われました。
発表内容
研究の背景
HBVは、非細胞障害性ウイルスです。そのため、HBV感染における肝障害の程度は、ウイルスの複製と宿主の免疫応答の間の複雑な相互作用に依存しています。HBV感染細胞の排除には、HBV特異的なCD8+T細胞応答や中和抗体応答を含む宿主免疫応答の複数のメカニズムが極めて重要です。しかしながら、慢性的にHBV感染が続くとこれらの宿主免疫応答に障害が生じることがわかっています。この障害が発生するメカニズムが解明されれば、HBV完全排除につながる治療法の開発につながると考えられますが、障害発生のメカニズムには不明な点が多く長年の検討課題となっています。
近年、癌細胞や免疫細胞をはじめ多くの細胞が、EVsを放出することにより、遠く離れた細胞まで情報を伝達する現象が発見され、注目を集めています。最近では、ウイルス感染細胞から放出されるEVsが宿主の免疫応答を制御することを示唆する報告が多数なされています。そこで、本研究では、HBV感染細胞から放出されるEVsが慢性B型肝炎時に生じる宿主免疫応答障害の原因の一つではないかという仮説を立て、これを検証することにしました。
研究内容
まず、本研究グループはHBV感染細胞から放出されるEVsが生体内においてどのような機能を有しているのかを、ハイドロダイナミックインジェクション法(Hydrodynamic injection:HDI)(注7)を用いたHBV感染マウスモデルを用いて検討することにしました。マウスの肝臓では、HBVの感染に必要なレセプターが発現していないため、HBVをマウスに投与してもマウスに感染しません。そこで、HDIを用いた遺伝子導入モデルがHBV感染マウスモデルとして用いられています。HBV感染患者血清から回収したEVsをHBV感染細胞由来EVs(HBV+ EVs)、健常者血清から回収したEVsをHBV非感染細胞由来EVs(HBV- EVs)とし、HBV感染マウスモデルに投与しました。その結果、HBV感染細胞由来EVsを投与したマウスの肝臓で多数のHBVが排除されずに残存することが確認されました(図1)。
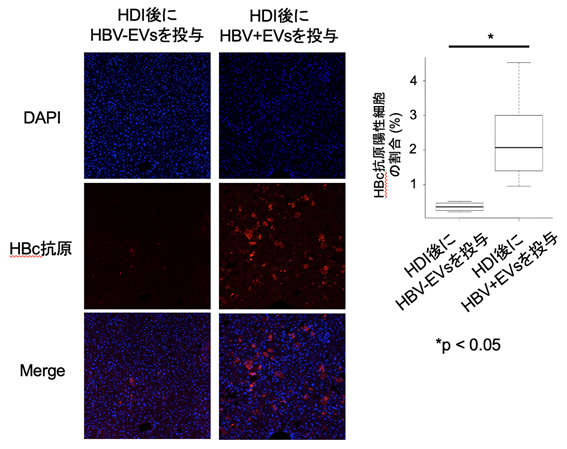
HDIを用いたHBV感染マウスモデルでは、肝臓所属リンパ節において、HBV排除に関与する抗HBV特異的免疫応答が誘導されることが報告されています。そこで、次に肝臓所属リンパ節における、各種免疫細胞の割合を検索しました。その結果、T細胞、B細胞、樹状細胞、マクロファージの割合に差は見られませんでした。
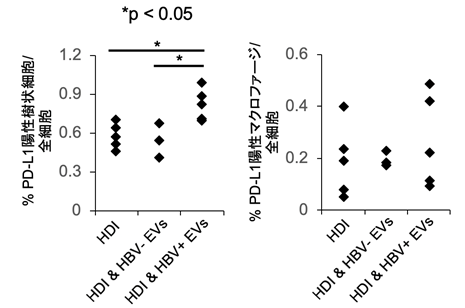
本研究グループは、以前の研究でHBV感染細胞由来EVsを取り込んだ単球系細胞でPD-L1の発現が上昇することを示しました。これをふまえて今回、肝臓所属リンパ節における単球系細胞のPD-L1の発現を検索しました。その結果、HBV感染細胞由来EVs投与群において、PD-L1陽性の樹状細胞の割合が増加していることが明らかになりました(図2)。この結果から、肝臓所属リンパ節においてPD-L1陽性の樹状細胞の割合が増加することでHBV特異的CD8+ T細胞を抑制している可能性が示唆されました。
次に、HBV感染細胞由来EVsがどの臓器に取り込まれるかを検索したところ全身性に取り込まれることがわかりました(図3)。
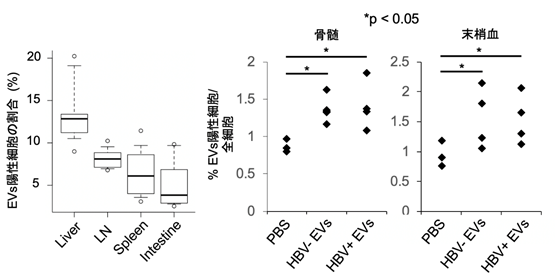
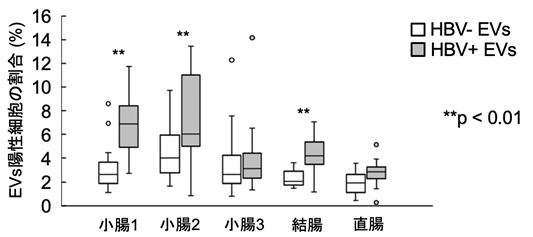
ここで、本研究グループは骨髄にEVsが取り込まれることに着目し、EVsを取り込んだ骨髄細胞がどのような挙動を示すのかを検索しました。蛍光ラベルしたEVsをマウスの骨髄細胞に取り込ませ、レシピエントマウスに移植しました。その結果、HBV感染細胞由来EVsを取り込んだ骨髄細胞は、腸管に集積しやすくなることが明らかになりました(図4)。この結果から、HBV感染細胞由来EVsを介した肝臓−骨髄−腸連関が存在することが明らかになりました。
今後の展開
これらの結果は、HBV持続感染のメカニズムの一つとしてHBV感染細胞由来EVsが重要であることを示しています。さらに、HBV感染細胞由来EVsを介した肝臓−骨髄−腸連関が存在することを示し、HBV感染細胞由来EVsが腸管へも何かしらの影響を与えている可能性を示唆していることから、B型肝炎の病態解明への一助になる可能性があります。
今後は、これらのデータをもとに、B型肝炎におけるHBV感染細胞由来EVsを介した肝臓―骨髄―腸連関の意義を検証し、B型肝炎の病態のさらなる解明を目指していきます。
用語
- (注1)B型肝炎ウイルス(Hepatitis B virus:HBV)
- 血液や体液などを介して肝臓に感染するDNAウイルス。感染したウイルスは炎症(肝炎)を惹起し、肝硬変や肝癌の原因となる。世界保健機関(WHO)は、B型肝炎ウイルス感染者は世界中で20億人、そのうちB型肝炎ウイルス持続感染者は2.57億人、さらに年間90万人がB型肝炎ウイルス関連疾患で死亡していると報告し、その克服を重要課題として挙げている。
- (注2)細胞外小胞(Extracellular vesicles:EVs)
- 細胞から放出される核を持たない脂質二重膜で囲まれた粒子。細胞外小胞は産生機構の違いから、エクソソーム、マイクロベシクル、アポトーシス小胞に分類されている。
- (注3)PD-L1
- PD-1(programmed cell death-1)受容体は活性化T細胞の表面上に、一方PD-1のリガンドのPD-L1、PD-L2は一部の癌細胞、抗原提示細胞の表面上に発現する。T細胞応答抑制に働く免疫チェックポイント・タンパク質である。PD-1/PD-L1、L2チェックポイント阻害ががん治療に非常に有望なことは、抗PD-1抗体の登場で明らかとなった。
- (注4)樹状細胞
- 樹状細胞は、生体内で免疫応答を制御する受容な役割を担う細胞で、特有な細胞突起を有し「樹状」の細胞形態を呈しており、リンパ組織のみならず広く全身に分布している。樹状細胞は、抗原を取り込んでリンパ節へ移動し、T細胞へ抗原の情報を伝達するだけでなく、その後の免疫応答の強さや方向性を決定する重要な役割を担っている。
- (注5)HBV特異的CD8+ T細胞
- 哺乳類にはCD8+ T細胞と呼ばれる免疫細胞が存在し、病原性微生物、特にウイルス排除に中心的な役割を果たすことが知られている。CD8+ T細胞はウイルス感染細胞などの標的細胞を認識することでパーフォリンやグランザイムを放出し、直接アポトーシスを誘導して傷害する。HBV感染細胞特異的に傷害するCD8+ T細胞がHBV特異的CD8+ T細胞である。慢性B型肝炎患者ではHBV特異的CD8+ T細胞でPD-1の発現が上昇しており、リガンドであるPD-L1の刺激が入りやすくなっている。
- (注6)HBVの持続感染
- HBVの感染には、感染してから数ヶ月後に体からウイルスが排除される「一過性感染」と、長期にわたってウイルスが肝臓に感染し続ける「持続感染」の2つの様式がある。HBVの持続感染の多くは出生時又は乳幼児期の感染によって成立する。持続感染者の大部分はHBVを体内に保持しているが、肝機能正常なHBe抗原陽性の無症候性HBVキャリアとなり、その後免疫能が発達するに従い、顕性又は不顕性の肝炎を発症する。そのうちの約90%はセロコンバージョン(HBe抗原の陰性化、HBe抗体の陽性化)を経て再び無症候性キャリアへと移行する。しかし、約10~15%の人は慢性肝疾患(慢性肝炎・肝硬変・肝がん)へ移行すると考えられている。
- (注7)ハイドロダイナミックインジェクション法(Hydrodynamic injection:HDI)
- マウスの尾静脈より比較的短時間に高圧で溶液を注入することで、生体内の細胞に簡便にDNAやRNAを導入する方法。発現用プラスミドの溶液で行うと肝細胞にも効率よく取り込まれ外来遺伝子の発現が肝臓で持続する。
論文情報
- 論文名
- Extracellular vesicles secreted by HBV-infected cells modulate HBV persistence in hydrodynamic HBV transfection mouse model.
- 著者名
- 柿崎正敏1、2、山本雄一朗2、大塚基之3、喜多村晃一4、伊藤誠敏5、川井秀樹6、村松正道4、加川建弘7、幸谷愛1、2(1東海大学医学部基盤診療学系先端医療科学、2東海大学総合医学研究所血液・腫瘍学研究部門、3東京大学大学院医学研究科内科学専攻消化器内科学、4国立感染症研究所ウイルス第二部、5東海大学生命科学統合支援センター、6創価大学理工学部共生創造理工学科、7東海大学医学部内科学系消化器内科学)
- 雑誌名
- Journal of Biological Chemistry
- DOI
- 10.1074/jbc.RA120.014317
- URL
- https://www.jbc.org/content/current
お問い合わせ先
研究に関する窓口
学校法人東海大学医学部 先端医療科学
教授 幸谷愛
TEL:0463-93-1121(内線)2781
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED) 疾患基礎研究事業部疾患基礎研究課
東京都千代田区大手町1-7-1 読売新聞ビル
TEL:03-6870-2225
E-mail:hepatitis“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年8月28日
最終更新日 令和2年8月28日


