プレスリリース 免疫抑制剤の要らない肝移植を普及させるための医師主導治験を開始―世界に先駆けた本邦発の画期的な再生医療 「誘導型抑制性T細胞」を用いた新たな治療法の実現へ―
プレスリリース
順天堂大学
日本医療研究開発機構
概要
順天堂大学奥村康特任教授・内田浩一郎准教授を中心とした研究グループは、日本移植学会の後援のもと、大学発ベンチャーの株式会社JUNTEN BIOと産学連携し、国立研究開発法人日本医療研究開発機構(AMED)の支援を受け、「生体肝移植における誘導型抑制性T細胞(JB-101)による免疫寛容誘導能及び安全性を評価するI/II相臨床試験」の治験届*1を独立行政法人医薬品医療機器総合機構(PMDA)に提出し、医師主導治験を開始することとなりました。
誘導型抑制性T細胞(以下、JB-101)は、移植された肝臓への免疫拒絶反応を完全に抑え、移植患者さんが生涯継続して内服する必要がある免疫抑制剤からの離脱(免疫寛容誘導)をサポートする画期的な再生医療等製品の候補として、令和2年度の厚生労働省の先駆け審査指定制度*2対象品目に指定されました。
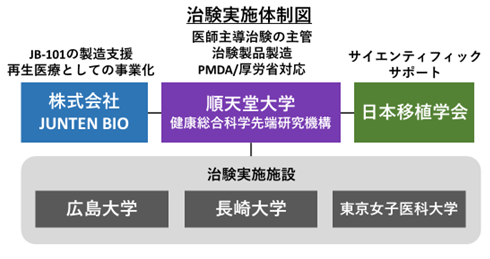
本治験は、肝移植において免疫抑制剤からの離脱(免疫寛容誘導)を実現する可能性を持ったJB-101の有効性と安全性の評価を目的とし、順天堂大学主管のもと、肝移植の実績が豊富で、免疫寛容研究に詳しい広島大学、長崎大学、東京女子医科大学にて実施されます。
本リリースのポイント
- 移植後、拒絶反応を予防するため免疫抑制剤の内服が生涯にわたり必要となり、重篤な感染症や発癌などの副作用リスクが移植医療最大の課題となっています。
- 本治験は、移植手術後にJB-101を1回投与し、有効性(免疫抑制剤からの離脱、免疫寛容誘導)と安全性を検証します。
- 本治験は、順天堂大学主管のもと、肝臓移植・研究の経験豊富な広島大学、長崎大学、東京女子医科大学で実施されます。
- JB-101の普及により、免疫抑制剤の長期内服による致死的な副作用を回避することができる新たな治療(免疫抑制法)への展開が期待されます。
背景
肝臓移植は国内で年間401例(2018年)行われており、様々な要因から肝機能が低下し、肝硬変*3へと進行していく患者の唯一の救命手段です。移植された肝臓への拒絶反応を抑えるための免疫抑制剤は、提供を受けたドナー臓器の機能を維持し、移植後の拒絶反応を抑えるために生涯に渡り内服が必要となります。しかし、免疫抑制剤の内服により生体の恒常性維持に必要な免疫機能も同時に抑制されることで、風邪や感染症にかかりやすくなり、糖尿病・腎機能障害や発がんなどの罹患リスクが上がるという副作用が生じます。この副作用により、移植患者さんの生活様式は大きく制限され、厳しい自己管理や内服する薬も増え、クオリティ・オブ・ライフの低下が課題となっています。
順天堂大学の研究グループは、ドナー臓器に対する免疫拒絶反応のみを選択的に抑制するTリンパ球(誘導型抑制性T細胞)を発見し、免疫寛容という拒絶反応のない状態を誘導することに長年取り組んできました。その成果として、2016年に誘導型抑制性T細胞により肝移植患者を免疫抑制剤から完全に離脱させることに成功しています。また、2019年には順天堂大学発の創薬ベンチャーである株式会社JUNTEN BIOとの共同研究により、誘導型抑制性T細胞「JB-101」を安定製造する方法を確立することに成功しました。今回、順天堂大学は日本移植学会の後援のもと、東京女子医科大学、広島大学、長崎大学の協力を得て、免疫抑制剤の要らない肝移植の実現に向けてJB-101の有効性および安全性を評価するための医師主導治験を行います。
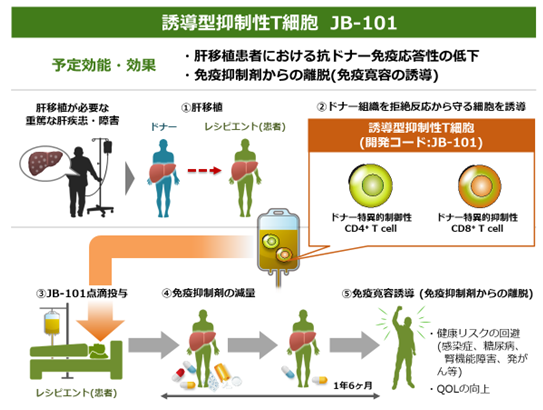
本治験の概要
本治験では肝移植前の観察期間において、同意取得後にスクリーニング検査を実施し、治験への参加について適格性を確認した後、ドナーより肝移植14日前~3日前までに、被験者より肝移植前日に、アフェレーシス法*4で末梢血単核球を採取します。ドナーと被験者から採取した白血球中の単核球とCD80/CD86抗体(T細胞を活性化させる分子)を共培養し、培養された単核球がドナー組織を拒絶から守る細胞(誘導型抑制性T細胞「JB-101」)に変化します。JB-101を投与する前処置として、体内リンパ球を一時的に減少させる目的で、シクロホスファミドを肝移植後5日目に投与します。その後、JB-101を肝移植から10日または11日後に患者に投与し、約1年6ヵ月かけて拒絶反応の有無を慎重に観察しながら段階的に免疫抑制剤を減らし、最終的に免疫抑制剤の投与を中止します(免疫抑制剤からの離脱)。なお、本治験では、免疫抑制剤からの離脱が1年間以上継続することを「免疫寛容*5」と定義し、JB-101の効果を評価します。本治験の結果は厚生労働省に提出され、審査されます。そこで効果と安全性に問題が無いことが確認されれば、再生医療等製品*6として承認されます(2026年中の実用化を目指しています)。本治験は、順天堂発及び日本発の再生医療研究シーズの実用化を目指すものであり、世界に展開していくための第一歩と位置付けています。
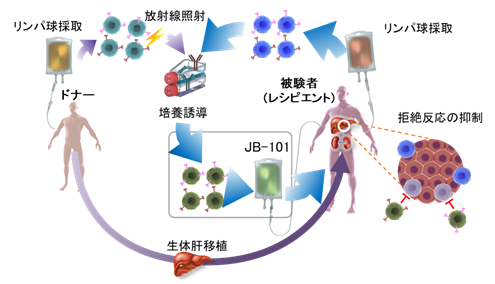
②順天堂大学はJUNTEN BIO社の製造支援を受け、JB-101を治験用に製造。
③広島大学・長崎大学・東京女子医科大学において治験を実施。
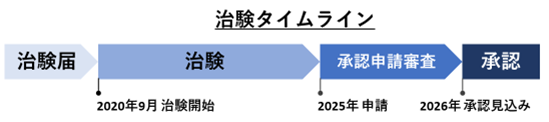
④治験は2020年9月から生体肝移植の適応となる20歳以上80歳未満の患者さんを対象に組み入れが始まり、2024年末に終了、その後、申請を経て承認審査。
⑤2026年中の承認を見込む。
※実施状況により変更の可能性があります。
用語解説
- *1 治験届
- 保健衛生上の見地から治験の実態を把握し、治験の安全性を確保するため、治験依頼者(製薬企業等)及び医師又は歯科医師(自ら治験を実施する者)は、厚生労働大臣への治験計画の届け出が義務づけられています。
- *2 厚生労働省 先駆け審査指定制度
- 世界に先駆けて開発され、早期の治験段階で著名な有効性が見込まれる医薬品等を指定し、早期の実用化を目指す制度のこと。
- *3 肝硬変
- 慢性肝炎などの慢性肝障害が少なくとも10年以上持続した結果、生じる病気。
- *4 アフェレーシス法
- 特殊な採血装置を使用して、患者さん又はドナーの体から血液を採取し、必要な成分(血漿成分や細胞成分)を分離して、体内に再び戻す処置のこと。
- *5 免疫寛容
- 特定抗原に対する特異的免疫反応の抑制状態のこと。
- *6 再生医療等製品
- 人又は動物の細胞に培養・その他の加工を施したもので、身体の構造・機能の再建、修復、形成、疾病の治療・予防に供されるもの。
本治験への支援
本治験は、AMEDの再生医療実用化研究事業「誘導型抑制性T細胞を用いた臓器移植における免疫寛容誘導を目指した第I/II相多施設共同医師主導治験」の支援を受け、多施設共同医師主導治験として実施します。
本治験にご協力いただいている皆様に深謝いたします。
お問い合わせ先
治験に関するお問い合わせ先
JB-101 医師主導治験 治験調整事務局TEL:03-3813-3111(代表)(内線2195) FAX:03-3814-3710
E-mail:jb101“AT”juntendo.ac.jp
研究内容に関するお問い合わせ先
治験調整医師
順天堂大学健康総合科学先端研究機構
准教授 内田浩一郎(うちだこういちろう)
TEL:03-5802-1591 FAX:03-3813-5512
E-mail:k-uchida“AT”juntendo.ac.jp
取材に関するお問い合わせ先
順天堂大学 総務局 総務部 文書・広報課(担当:松浦、長嶋)
TEL:03-5802-1006 FAX:03-3814-9100
E-mail:pr“AT”juntendo.ac.jp
順天堂
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
TEL:03-6870-2220 FAX:03-6870-2246
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年9月4日
最終更新日 令和2年9月4日


